10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50 ℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为:该溶液pH升高的原因是HCO的水解程度增大,碱性增强。
乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3的水解程度(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则________(填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是_____________________。
(4)关于NaHCO3饱和水溶液的表述正确的是_______________________。
a.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
c.HCO3-的电离程度大于HCO3-的水解程度
常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3、②NaHCO3、③HCl、④NH3·H2O
(1)上述溶液中,可发生水解的是______(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为:____________________________________。
(3)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值_____(填“增大”、“减小”、或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________________。
(5)取10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A H++HA- HA-
H++HA- HA- H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-)(α表示弱电解质的电离程度),设有下列四种溶液:
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号):
(1)c(H+)最大的是________,最小的是________。
(2)c(H2A)最大的是________,最小的是________。
(3)c(A2-)最大的是________,最小的是________。
某硫酸厂用以下几种方法处理SO2尾气。

(1)活性炭还原法
反应原理:恒温恒容2C (s)+2SO2(g) S2(g)+2CO2(g) 。
S2(g)+2CO2(g) 。
反应进行到不同时间测得各物质的浓度如图:
①第一次出现平衡的时间是第 min;
②0~20min反应速率表示为V(SO2)= ;
③30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是 ;40min时,平衡常数值为__________。
(2)亚硫酸钠吸牧法
①Na2SO3溶液吸收SO2的离子方程式为 ;
②常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)
a.c(Na+)+c(H+) >c(SO32-)+c(HSO3-)+ c(OH-)
b.c(Na+) = c(SO32-) + c(HSO3-)+ C(H2SO3)
c.c(Na+)> c(SO32-)> c(OH-)>c(H+)
d.水电离出c(OH一)=l×l0-8 mol/L,
(3)电化学处理法
如图所示,Pt(1)电极的反应式为 ;碱性条件下,用Pt(2)电极排出的S2O42-溶液吸收NO2,使其转化为N2,同时有SO32-生成。若阳极转移电子6mol,则理论上处理NO2气体 mol。

写出下列盐类水解的离子方程式,并指出其溶液的酸碱性。
(1)硫酸铝溶液: (显 性)。
(2)硝酸铵溶液: (显_ 性)。
(3)次氯酸钠溶液: (显_ 性)。
(4)碳酸氢钠溶液: (显_ 性)。
25℃时,0.1 mol/L的HA溶液中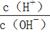 =1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
=1010,0.01 mol/L的BOH溶液pH=12。请回答下列问题:
(1)HA是_________(填“强电解质”或“弱电解质”,下同),BOH是__________。
(2)HA的电离方程式是_______________________________________。
其中由水电离出的c(H+)=________mol/L
(3)在加水稀释HA的过程中,随着水量的增加而减小的是_______(填字母)。
A.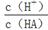 |
B.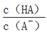 |
| C.c(H+)与c(OH-)的乘积 |
| D.c(OH-) |
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈 性,请用离子方程式解释其原因_____________,混合溶液中各离子浓度由大到小的顺序是 。
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11。(混合溶液体积变化忽略不计),应加_________mL(保留到小数点后一位)
(1)CuSO4的水溶液呈 (填“酸”、“中”、“碱”) 性,常温时的pH 7(填“>”或“=”或“<”),实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于硫酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)泡沫灭火器中的主要成分是Al2(SO4)3和NaHCO3溶液,反应的离子方程式为 。
(1)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“>”或“=”或“<”)。
(2)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH—)= mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)= mol/L,由水电离产生的c(H+)= mol/L,此时温度 25℃(填“高于”、“低于”或“等于”)。
判断下列盐溶液的酸碱性,能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样。
K2CO3溶液呈 性 ;
K2SO4溶液呈 性 ;
FeCl3溶液呈 性 ;
食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知: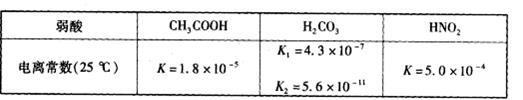
请回答下列问题:
(1)定温度下,向0.1 mol·L-1 CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号)。
a.溶液的pH增大
b.CH3COOH的电离程度增大
c.溶液的导电能力减弱
d.溶液中c(OH- ).c(H+)不变
(2)25℃时,0.10 mol·L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-):_____ mol·L-1。
(3)常温下,将20 mL 0.10 mol·L-1CH3COOH溶液和20 mL 0.10 mol·L-1HNO2溶液分别与20 mL 0.10 mol·L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v(CH3COOH)_________v(HNO2)(填“>”、“<”或“:”),原因是_________.
②充分反应后.两溶液中c(CH3COO-)_________c(NO2-)(填“>”、“<”或“=”)。
(4)25 C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中
C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中 =__________。
=__________。
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 。
(4)已知t℃,KW=1×10-13,在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
常温下有浓度均为0.5mol・L-1的四种溶液:①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水。请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的是 (填序号,下同),在发生水解反应的溶液中pH最大的是 。
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是 。该物质水解的离子方程式为 。
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中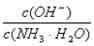 的值 (填“增大”或“减小”或“不变”)
的值 (填“增大”或“减小”或“不变”)
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)= 。
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是_______________(填序号);
(2)若溶液中只有一种溶质,则该溶质为__________,该溶液中离子浓度的大小关系为_______(填序号);
(3)若关系③正确,则溶液中溶质为_________;
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显_________(填“酸性”、“碱性”、“中性”)。
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va__________Vb(填>、<、=、无法确定)。
写出下列电解质在水溶液中的电离方程式
(1)Ca(HCO3)2:_____________________________;
(2)H2SO3:_____________________________;
写出下列电解质在水溶液中的水解离子方程式
(3)CH3COONa:_____________________________;
(4)Fe2(SO4)3:_____________________________。
(原创)I.现有以下物质:①铁 ②稀硝酸 ③明矾 ④液氨 ⑤冰醋酸 ⑥蔗糖溶液 ⑦无水乙醇 ⑧熔融态的氢氧化钠⑨硫酸钡晶体 ⑩三氧化硫气体,回答下列问题(用相应物质序号填写):
(1)可以导电的有 。(2)属于强电解质的有 。
II. A、B、C、D四种溶液分别是氢氧化钡溶液、氨水、醋酸溶液、盐酸中的一种。
已知同浓度的四种溶液:①加入大小完全相同的锌粒,仅A、C中放出气体,且开始时A中冒气泡的速度快;②相同条件下,取B、D溶液进行导电性实验,发现导电能力最差的是D。回答下列问题:
(3)D溶液为 ;同浓度的四种溶液中,pH值最大的是 (填化学式) 溶液。
(4)pH值和体积均相同的A和C溶液,分别与足量且大小完全相同的锌粒反应,开始时的反应速率v(A) v(C) (填“>”、“<”或“=”,下同),最终产生气体的物质的量n(A) n(C)。
(5)等体积等浓度的氨水和盐酸混合后,所得溶液呈 (填“酸性”、“碱性”或“中性”),用离子方程式解释其原因 。
(6)0.1mol/L氨水中除水分子以外的粒子有 (填化学式)。
试题篮
()