(共8分)
(1)物质的量浓度相同的①氨水;②氯化铵;⑧碳酸氢铵;④硫酸氢铵;⑤硫酸铵5种溶液中c(NH4+)的大小顺序是______,溶液pH的大小顺序是______。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 ..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 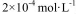 ,则生成沉淀所需CaCl2溶液的最小浓度为 。
,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)己知: 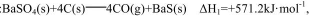

则反应 
(1)下列化学原理的应用,主要用沉淀溶解平衡原理来解释的
是 :
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用
时,常用0.5%的Na2SO4溶液解毒;③石灰岩(喀斯特地貌)的溶洞形成;④BaCO3不能做“钡餐”,而BaSO4则可以;⑤使用泡沫灭火器时“泡沫”生成的原理。
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
(2)氯化铝水溶液呈 性 ,其离子方程式表示为 ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(1)将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2= (溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合而得,则溶液的pH 7
②若溶液pH<7,则c(Na+) c(A-)
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则
下列说法正确的是 (填选项代号).
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
请按要求完成下列各项填空:
(1)AlCl3的水溶液呈 (填“酸”、“中”或“碱”)性,常温时的pH 7(填“>”、“<”或“=”),原因是(用离子方程式表示): ;实验室在配制 AlCl3溶液时,常将 AlCl3固体先溶于浓盐酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”或“抑制”)其水解。将AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是 (填化学式)。
(2)在纯碱溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是___________________________________________,其原因是(以离子方程式和简要的文字说明):
__________________________________________________________________________。
工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①常温下,测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因 。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为 。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)  Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①H2S气体与足量NaOH溶液反应的化学方程式
②铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式: 。
(1)CuSO4的水溶液呈 (填“酸”、“中”、“碱”) 性,常温时的pH 7(填“>”或“=”或“<”),实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于硫酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)泡沫灭火器中的主要成分是Al2(SO4)3和NaHCO3溶液,反应的离子方程式为 。
在25℃时,将酸HA与碱MOH等体积混合.
(1)若0.01mol/L的强酸HA与0.01mol/L强碱MOH混合,则所得溶液显 (填“酸性”、“中性”或“碱性”,下同)该反应的离子方程式为
(2)若pH=3的强酸HA与pH=11的弱碱MOH混合,则所得溶液显 ,理由是:
(3)若0.01mol/L的强酸HA与0.01mol/L弱碱MOH混合,则所得溶液显 ,解释这一现象的离子方程式是
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液
(2)各取5mL上述溶液,分别加热(温度相同),pH较小的是________溶液
(3)H2SO4溶液和NH4Cl溶液中由水电离出的c(H+)之比为__________
(4)取5mL NH4Cl溶液,加水稀释至50mL,c(H+) ____________ 10-6mol·L-1(填“>”、“<”或“=”),
c(NH4+)/c(H+)_______________(填“增大”、“减小”或“不变”)
(1)请写出下列溶液的离子反应方程式:(13分)
①硫酸氢钠在溶液中的电离:
②氯化铵溶液除铁锈的原因:
③氯化铁溶液与偏铝酸钾溶液混合:
④碳酸钙的溶解平衡:
(2)在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,
以 (填“促进”、“抑制”)其水解。在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产是 。把Na2SO3溶液蒸干,灼烧,最后得到的主要固体产是 。
(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH-的物质的量浓度分别为A和B,则A和B的关系为 。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若在该溶液中再滴入过量的BaCl2溶液,所观察到的现象是 ,其原因是 。
(3)对于盐AmBn的溶液:①若为强酸弱碱盐,其水解的离子方程式是 ;②若为弱酸强碱盐,其水解的离子方程式是 。
水溶液中存在多种平衡,请根据所学化学知识回答下列问题:
(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)
(2)浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
(1)25℃时,pH=12.0的KOH溶液中,由水电离出的c(OH-)=_______mol/L;pH=12.0的K2CO3溶液中,由水电离出来的c(OH-)=_______mol/L。
(2)常温下0.1mol·L-1 CH3COONa溶液PH=8
①用离子方程式表示CH3COONa溶液PH=8的原因: 。
②按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外) 。
(3)FeCl3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): 。
现有NH4Cl和氨水组成的混合溶液。请回答下列问题(填“>”、“<”或“=”):
(1)若溶液的pH=7,则该溶液中c(NH )_________c (Cl—)。
)_________c (Cl—)。
(2)若溶液的pH>7,则该溶液中c(NH+)_________c(Cl—)。
(3)若c(NH )<c (Cl—),则溶液的pH__________7。
)<c (Cl—),则溶液的pH__________7。
请写出下列溶液水解(或双水解)的离子反应方程式:
(1)次氯酸钠溶液:
(2)硫酸铵溶液:
(3)明矾净水原理:
(4)泡沫灭火器工作原理:
(5) 氯化铁溶液与偏铝酸钾溶液混合:
(共8分)在常温下,下列六种溶液:
①0.1mol/L ②0.1mol/L
②0.1mol/L ③0.1mol/L
③0.1mol/L
④0.1mol/L 和0.1mol/L
和0.1mol/L 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L ⑥0.1mol/LNH4HCO3
⑥0.1mol/LNH4HCO3
请根据要求填写下列空白:
(1)溶液①呈 性,其原因是 (用离子方程式表示)
(2)在上述六种溶液中, 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号)
(3)比较溶液②、③中 的大小关系是② ③(填“>” “<”或“=”)
的大小关系是② ③(填“>” “<”或“=”)
(4)常温下,测得溶液② ,说明
,说明 水解程度
水解程度  水解程度。(填“>”、“<”或“=”)
水解程度。(填“>”、“<”或“=”)
(5)请写出③的电离方程式: 。
(6)请写出0.1mol/L的NH4HCO3物料守恒关系式:
试题篮
()