(Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示。
(1)写出a点溶液呈酸性的离子方程式:
(2)若c点时V(NaOH)为90ml,则Al2(SO4)3溶液的物质的量浓度约为:
(3)写出b~c段反应的离子方程式: ,
(4)d点时,V(NaOH)约为
(Ⅱ)常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”、“减小”或“不变”)。
(2)若将③和④的溶液混合后溶液恰好呈中性则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
写出下列物质在水溶液中的电离方程式或离子水解方程式。
1、写出下列三种物质的电离方程式
(1) HClO 。
(2)CH3COONa 。
(3)NH3·H2O 。
2、写出下列三种物质的离子水解方程式
(4)CH3COONa 。
(5)NH4Cl 。
(6)NaF 。
(14分)25℃时0.1 mol/L的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:
甲认为:醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;
乙认为:醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大.
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH.(已知25℃时,CH3COONH4溶液呈中性).
| A.固体CH3COOK | B.固体CH3COONH4 |
| C.气体NH3 | D.固体NaHCO3 |
(2)加入(1)中物质后,若甲的解释正确,溶液的pH应________;若乙的解释正确,溶液的pH应________;(填“增大”“减小”或“不变”).
(3)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液.判断:
①溶液中共有________种粒子;
②其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________;
③溶液中n(CH3COO-)+n(OH-)-n(H+)=________mol.
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。
已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)= __。
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。
①检验晶体中含有NH4+的方法为 。
②等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4
c.(NH4) 2SO4 d.(NH4)2SO3,
其中c(NH4+)由大到小的顺序为 __(填选项字母)。
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为 __。
②用铂做电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为 __,电解过程中阴极附近溶液的pH将 __(填“增大”“减小”或“不变”)。
③产品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以 __为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-=2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该产品中K2S2O8的质量分数为(杂质不参加反应) __(列式并计算)。
现有常温下的六份溶液:
①0.01 mol/L CH3COOH溶液;
②0.01 mol/L HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是_______(填序号,下同),水的电离程度相同的是__________。
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②___③(填“>”,“<”或“=”)
(3)将六份溶液同等稀释10倍后,溶液的pH:
①________②,③________④,⑤________⑥(填“>”、“<”或“=”)。
(4)将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈________(填序号)。
A.酸性 B.碱性 C.中性
现有浓度均为0.1mol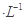 的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(l)①、②、③、④四种溶液中由水电离出的浓度由大到小的顺序是___________________
_____________________________________(填序号)。
(2)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是_________________(填序号)。
(3)将③和④按体积比l:2混合后,溶液的pH>7,则混合液中各离子浓度由大到小的顺序是________________________________________。
(4)已知t℃时,Kw=1×10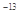 ,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。
,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。
(每空2分,共8分)二元酸H2A在水中的电离情况是:H2A=H++HA-和HA- H++A2-,写出下列物质的水溶液的相应关系式:
H++A2-,写出下列物质的水溶液的相应关系式:
(1)NaHA溶液中的离子浓度大小关系:
(2)NaHA溶液的物料守恒式:
(3)NaHA溶液的电荷守恒式:
(4)NaHA溶液的质子守恒式:
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为(填序号)________________。
(2)若四种离子的关系符合③,则溶质为 ;若四种离子的关系符合④,则溶质为 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图象正确的是(填图象符号)________。
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”)。
下图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1CH3COONa 溶液,并分别放置在盛有水的烧杯中,
然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
(1)含酚酞的0.01 mol·L-1CH3COONa溶液显浅红色的原因为(用离子方程式表达)________.
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是______。
| A.水解反应为放热反应 |
| B.水解反应为吸热反应 |
| C.NH4NO3溶于水时放出热量 |
| D.NH4NO3溶于水时吸收热量 |
(3)向0.01 mol·L-1CH3COONa溶液中分别加入NaCl固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为___________、______、_________。(填“左”、“右”或“不移动”)
(6分)下列实验操作,最终得到的固体物质为 (填化学式)
(1)将K2CO3溶液蒸干____________________________
(2)将Na2SO3溶液蒸干___________________________
(3)将AlCl3溶液蒸干并灼烧_______________________
(10分)今有①CH3COOH ②HCl ③H2SO4三种溶液。根据要求回答下列问题:
(1)当它们pH相同时,其物质的量浓度由大到小排列是________________(填序号)
(2)当它们的物质的量浓度相同时,其pH由大到小的顺序是______________(填序号)
(3)中和等量的同一烧碱溶液,需相同的物质的量浓度的①②③三种酸溶液的体积比为
___________________________________。
(4)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为_____________________;此时所得到的三种溶液的pH大小关系为______________________。
某学生用浓度为0.1 mol/L左右的KOH溶液滴定未知浓度的盐酸,有如下操作步骤:
(A)移取20.00 mL待测的盐酸注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用KOH溶液润洗滴定管2—3次
(C)把盛有KOH溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取KOH溶液注入碱式滴定管至0刻度以上2—3 cm
(E)调节液面至O或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用KOH溶液滴定至终点,记下滴定管液面的刻度
回答下列问题:
(1)正确操作的顺序是 (填编号)
(2)实验室可提供下列浓度的KOH浓液,应选用的是 。(填编号)
A.0.1 mol/L B.O.10 m01/L C.O.1032 mol/L
(3)(A)操作中量取待测液的仪器是 o
(4)(B)操作的目的是 .
(5)(F)操作中判断到达终点的现象是 。
(6)(B)如被省略所测结果 (填“偏大”、“偏小”、“不变”).
(7)KOH溶液在空气中易变质生成 ,该物质水溶液PH 7,其水溶液中离子浓度大小排序为
(8)(C)步如何使滴定管尖嘴充满溶液
(每空1分,共11分)写出有关离子方程式
(1)Na2SO4溶液中滴加Ba(OH)2:
(2)H2S的电离方程:
(3)NH4Cl溶液显 性:
(4)纯碱溶液显 性:
(5)将FeCl3饱和溶液滴入沸水中:
(6)用明矾净水:
(7)在配制AlCl3溶液时,为了防止发生水解,可以加入少量的 ;在配制FeSO4溶液时,为了防止溶液变质,可以加入少量的 和 。
已知:
①25℃时弱电解质电离平衡数;
难溶电解质的溶度积常数:
②25口C时,2×l0 mol
mol 氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、c(F-)与溶液pH的变化关系,如下图所示:
氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、c(F-)与溶液pH的变化关系,如下图所示:

请根据以下信息回答下列问题:
(1) 25℃时,将20mL 0.10 mol  CH3COOH溶液和20mL O.l mol
CH3COOH溶液和20mL O.l mol HSCN溶液分别与20mL 0.10 mol
HSCN溶液分别与20mL 0.10 mol NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为上图所示:
NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为上图所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因
是_____________________________________________________________,
反应结束后所得两溶液中,C(CH3COO-)_______c(SCN-)(填“>”、“<”或“=”)
(2) 25℃时,HF电离平衡常数的数值Ka≈_________。
(3)4×10 mol
mol HF溶液与4×10
HF溶液与4×10 mol·
mol· CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
根据所学知识完成下列空白。
Ⅰ.(1) 的名称(系统命名法)是 。
的名称(系统命名法)是 。
(2)(CH3)3CCH2CH(CH2CH3)CH(CH3)2的名称(系统命名法)是 。
(3)2,3-二甲基-4-乙基已烷 的结构简式______________________________。
Ⅱ.某盐的化学式为XmYn(m≠n),在水中能完全电离:XmYn=mXn++nYm-。将一定量的盐溶于足量水时:
(1)若测得溶液的pH为9,则该盐与水反应的离子方程式可能为: (用X或Y表示)。
(2)若X、Y为同周期的短周期元素,XmYn溶于水时,有白色沉淀产生,又有无色气体放出,则XmYn溶于水的化学方程式为:_________________________(用元素符号表示)。
试题篮
()