研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳 源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。能判断该反应达到化学平衡状态的依据是_____________。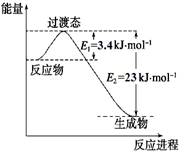
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol[ |
平衡量/mol |
达到平衡所需 时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正 V逆(填“<”,“>”,“=”)。
(3)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为________;
(13分)硫、碳、氮等元素及其化合物与人类的生产生活密切相关,其中.硫酸、氨气、硝酸都是重要的化工原料.而SO2、NO、NO2、CO等相应氧化物又是主要的环境污染物:
(1)过度排放CO2会造成“温室效应”,而煤的气化是高效、清洁利用煤炭的重要途径。煤综合利用的一种途径如图所示。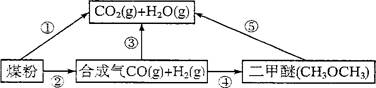
已知:C(s)+H2O(g)=CO(g)+H2(g) AH1= +131.3 kJ·mol-
C(s)十2H2O(g)=CO2(g)+2H2(g) AH2=" +90" kJ·mol-
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)298 K时.将氨气放入体积固定的密闭容器中使其发生分解反应。当反应达到平衡状态后.改变其中一个条件X,Y随X的变化符合图中曲线的是 (填字号):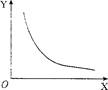
a.当X表示温度时,Y表示氨气的物质的量
b.当X表示压强时.Y表示氨气的转化率
c.当X表示反应时间时.Y表示混合气体的密度
d.当x表示氨气的物质的量时.Y表示某一生成物的物质的量
(3)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染.必须经脱除达标后才能排放:能作脱除剂的物质很多.下列说法正确的是 (填序号):
a.用H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
d.用尿素[CO(NH2)2]作脱除剂.在一定条件下能有效将NOx氧化为N2
(4)在压强为O.1 MPa条件下,容积为V L的密闭容器中,amol CO与2amol H2在催化剂作用下反应生成甲醇。反应的化学方程式为CO(g)+2H2(g)  CH3OH(g),CO的平衡转比率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转比率与温度、压强的关系如图所示,则: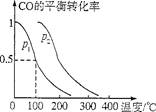
①P1 P2(填“>”“<”或“=”)。
②在其他条件不变的情况下,向容器中增加a molCO与2amol H2.达到新平衡时.CO的转化率 (填“增大””减小”或“不变”.下同),平衡常数 .
③在P1下、100℃时,CH3OH(g)  CO(g)十2H2(g)的平衡常数为 (用含a、V的代数式表示)。
CO(g)十2H2(g)的平衡常数为 (用含a、V的代数式表示)。
(5)①常温下.若将2 mol NH3(g)和l mol CO2(g)通入1 L水中.可得pH=10的溶液,则该溶液中浓度最大的阴离子是 ;
②常温下,将0.01 mol·L- NaOH溶液和0.01 mol·L-(NH4)2SO4溶液等体积混合.所得溶液pH为10,那么该混合液中c(Na+)+c(NH4+)= mol·L一(填准确代数式.不能估算)。
近年来大气问题受到人们越来越多的关注。按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。

则p1、p2、p3、p4由大到小的顺序 ,该反应的正反应是______(填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K=________。
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx。
(1) 处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H1=-574kJ·mol-1
CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ·mol-1
CH4(g) + 2NO2 (g) = N2(g) + CO2(g) + 2H2O(g) △H3
则△H3= ,如果三个反应的平衡常数依次为K1、K2、K3,则K3=______(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol·L-1NaOH溶液通入SO2过程中的pH变化曲线如图所示。

①ab段发生反应的离子方程式为________________。
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为_______,如果NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则该温度下H2SO3的第一步电离平衡常数Ka=_________________。
SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
(1)装置Ⅰ中生成HSO3-的离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。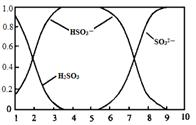
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。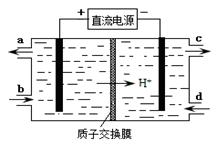
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L(用含a代数式表示,计算结果保留整数).
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1mol•L-1 100 mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是 (结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或 “不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
实验①可说明 (填字母)
| A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L |
| B.H2S2O3是一种弱酸 |
| C.Na2S2O3是一种弱电解质 |
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH— H2S2O3+2OH— |
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答:
①此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果 (填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
(Ⅰ)A、B、C、D、E五种溶液分别为NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1LpH=3的A溶液分别与0.001mol/L xLB溶液、0.001mol/L yLD溶液充分反应至中性,x、y大小关系为:y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是_____________溶液
(2)用水稀释0.1mol/LB时,溶液中随着水量的增加而减小的是_____________(填写序号)
① ;②
;② ;③c(H+)和c(OH-)的乘积;④OH-的物质的量
;③c(H+)和c(OH-)的乘积;④OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别和锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_____________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中的_____________曲线(填写序号).
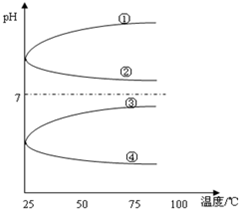
(5)室温下,向0.01mol/LC溶液中滴加0.01mol/LD溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_____________.
(Ⅱ)如下图所示 ,横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数,回答下列问题。
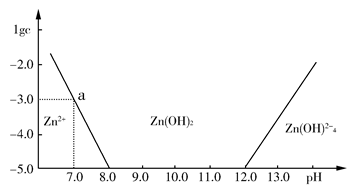
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=_______________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________________________。
氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。(1)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。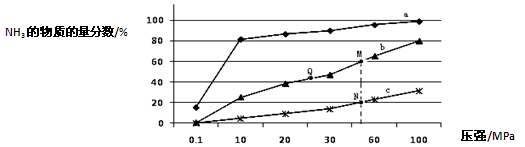
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③M点对应的H2转化率是 。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
①当氨水中所含氨的物质的量3mol,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
②NH4HSO3溶液显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理: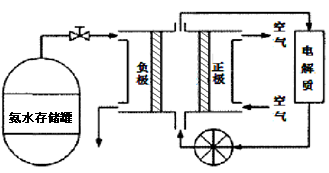
①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方程式是 。
高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料。
(1)FeO42-与水反应的方程式为:4FeO42-+ 10H2O 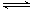 4Fe(OH)3 + 8OH-+ 3O2,
4Fe(OH)3 + 8OH-+ 3O2,
K2FeO4在处理水的过程中所起的作用是________。
(2)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为____________________________。
(3)将适量K2FeO4配制成c(FeO42-)=1.0×10-3 mol/L(1.0mmol/L)的试样,FeO42-在水溶液中的存在形态如右图所示。下列说法正确的是(填字母)。
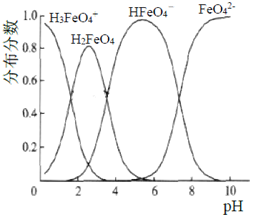
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4- H++FeO42-的电离平衡常数表达式为K=______________,其数值接近_______(填字母)。
H++FeO42-的电离平衡常数表达式为K=______________,其数值接近_______(填字母)。
A.10-2.5 B.10-6 C.10-7 D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL1.0×10-3 mol/L的K2FeO4溶液中的c(FeO42-)完全沉淀,则理论上需控制溶液中Ca2+浓度至少为__________。
(15分)高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景。
(1)湿法制备K2FeO4:在KOH溶液中,用KC10直接氧化Fe(NO3)3即可制得K2FeO4。该反应的离子方程式为_________________________________。
(2)测定K2FeO4:样品纯度:i.称取样品mg,加入到盛有过量碱性亚铬酸钠[NaCr(OH)4]溶液的锥形瓶中充分反应;ii.将所得铬酸钠(Na2CrO4)溶液酸化;iii.在所得Na2Cr2O7溶液中加入8—9滴二苯胺磺酸钠溶液作指示剂,用c mol·L-1(NH4)2Fe(SO4)2溶液滴定至终点,消耗溶液体积为V mL。整个过程中发生的反应如下:
i. Cr(OH)4- + FeO42-+  = Fe(OH)3 (H2O)3↓+ CrO42-+
= Fe(OH)3 (H2O)3↓+ CrO42-+
ii.2CrO42-+2H+=Cr2O72-+H2O;
iii.Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
①配平方程式i;
②利用上述数据计算该样品的纯度为________________(用含字母的代数式表示)。
(3)高铁酸盐在水溶液中有四种含铁形体。25 ℃时,它们的物质的量分数随pH的变化如图所示:
i.pH=2.2时,溶液中主要含铁形体浓度的大小关系为________;为获得尽可能纯净的高铁酸盐,pH应控制在______________。
ii.已知H3FeO4+ 的电离常数分别为:K1=2.51×10-2,K2=4.16×10-4,K3=5.01×10-8,当pH=4时,溶液中 = 。
= 。
iii.向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为______________。
(4)某新型电池以金属锂为负极,K2FeO4为正极,溶有LiPF6的有机溶剂为电解质。工作时Li+通过电解质迁移人K2FeO4晶体中,生成K2Li2FeO4。该电池的正极反应式为______________.
具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
高效,且腐蚀性小。请回答下列问题:
(1)净水的原理是。
溶液腐蚀钢铁设备,除
作用外,另一主要原因是(用离子方程式表示)。
(2)为节约成本,工业上用氧化酸性
废液得到
。
①若酸性废液中
=2.0×10-2
·
,
=1.0×10-3
·
,
=5.3×10-2
·
,则该溶液的
约为。
②完成氧化
的离子方程式:
+
+=
+
+
(3)在溶液中分三步水解:
+

+
+
![]()
+
+

+
以上水解反应的平衡常数、
、
由大到小的顺序是。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:+

欲使平衡正向移动可采用的方法是(填序号)。
.降温
.加水稀释
.加入NH4Cl
.加入
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是。
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以·
表示]的最佳范围约为
·
。
(14分)工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素)。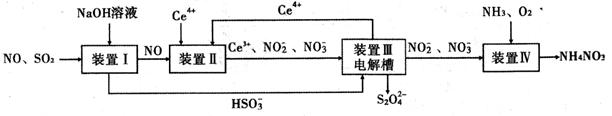
请回答下列问题。
(1)装置Ⅱ中NO在酸性条件下生成NO2—的离子方程式 。
(2)含硫各微粒(H2SO3、HSO3—和SO32—)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如下图所示。
①下列说法正确的是 (填标号)。
| A.pH=7时,溶液中c( Na+)<c (HSO-3) + c(SO2-3) |
| B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7 |
| C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜 |
| D.pH=2和 pH=9时的溶液中所含粒子种类不同 |
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的离子方程式为 。
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定。酸性高锰酸钾溶液应装在 (填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 。
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。图中A为电源的 (填“正”或“负”)极。右侧反应室中发生的主要电极反应式为 。
(4)已知进入装置Ⅳ的溶液中NO2—的浓度为 0.4 mol/L ,要使 1m3该溶液中的NO2—完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L。
二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料。
(1)将a mol SO2通入1 L 1 mol/L NaOH溶液中充分反应后,阴离子总数 阳离子总数(填选项前的字母)。
A.a>1时大于 B.a=1时等于 C.大于 D.小于
(2)保险粉(Na2S2O4)广泛用于印染行业和食品储存行业。可以将SO2通入草酸钠(Na2C2O4)和NaOH的混合溶液中制取保险粉。制取保险粉的离子方程式为 。
(3)工业上常以SO2为原料制取Na2S2O3。步骤如下:
①将Na2S和Na2CO3按2︰1的物质的量之比配成混合溶液。
②将混合溶液注入敞口反应釜中,加热反应釜将温度控制在50℃左右。
③向反应釜中缓缓通入SO2至稍微过量使Na2S和Na2CO3完全反应。
④反应结束后加热浓缩溶液,冷却至30℃以下析出大量Na2S2O3晶体。
⑤滤出晶体,母液循环利用。
据此请回答:
(ⅰ)工业制取Na2S2O3的反应的化学方程式为 。
(ⅱ)工业生产的首要目的是盈利,为节约成本并减少对环境的污染,应尽可能的提高产率,制取步骤中体现了这一思想的有 (填步骤序号)。
(ⅲ)工业生产的Na2S2O3含有两种杂质,这两种杂质是Na2SO3和 。以下条件中可以求出产品中Na2S2O3的物质的量分数的是 。(填选项前的字母)
A.产品中钠原子和硫原子的物质的量之比
B.产品中钠原子和氧原子的物质的量之比
C.产品中硫原子和氧原子的物质的量之比
D.以上均能
(4)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
每吸收标准状况下11.2 L SO2,被SO2还原的O2的质量为 g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。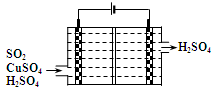
某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用。某校研究小组尝试回收废旧正极材料中的钴。
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2 + 4H+ + e- ="==" Li+ + Co2+ + 2H2O 、 。
阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4) > 0.4 mol·L-1时,钴的浸出率下降,其原因可能为 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。
①写出“酸浸”过程中正极粉发生反应的化学方程式 。该步骤一般在80℃以下进行,温度不能太高的原因是 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
a.c (NH4+)> c(C2O42-)>c (H+)>c (OH-)
b.c (H+) +c (NH4+) ="c" (OH-) + c(HC2O4-)+c(C2O42-)
c.c (NH4+)+ c (NH3•H2O) = 2[c(C2O42-) + c(HC2O4-) + c(H2C2O4)]
(3)已知所用锂离子电池的正极材料为x g,其中LiCoO2(M =" 98" g·mol-1)的质量分数为a%,则回收后得到CoC2O4•2H2O (M =" 183" g·mol-1)的质量不高于 g。
高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景。
(1)湿法制备K2FeO4:在KOH溶液中,用KClO直接氧化Fe(NO3)3即可制得K2FeO4。该反应的离子方程式为_________________________________。
(2)测定K2FeO4:样品纯度:i.称取样品mg,加入到盛有过量碱性亚铬酸钠[NaCr(OH)4]溶液的锥形瓶中充分反应;ii.将所得铬酸钠(Na2CrO4)溶液酸化;iii.在所得Na2Cr2O7溶液中加入8—9滴二苯胺磺酸钠溶液作指示剂,用c mol·L-1(NH4)2Fe(SO4)2溶液滴定至终点,消耗溶液体积为V mL。整个过程中发生的反应如下:
ⅰ._Cr(OH)4-+_FeO42- +__ =__Fe(OH)3(H2O)3↓+__CrO42-+__
=__Fe(OH)3(H2O)3↓+__CrO42-+__
ⅱ.2CrO42- + 2H+=Cr2O72- + H2O;
ⅲ.Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O
①配平方程式i;
②利用上述数据计算该样品的纯度为________________(用含字母的代数式表示)。
(3)高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
①pH=2.2时,溶液中主要含铁形体浓度的大小关系为________;为获得尽可能纯净的高铁酸盐,pH应控制在______________。
②已知H3FeO4+的电离常数分别为:
当PH=4时,溶液中 =___________。
=___________。
③向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为______________。
(4)某新型电池以金属锂为负极,K2FeO4为正极,溶有LiPF6的有机溶剂为电解质。工作时Li+通过电解质迁移入K2FeO4晶体中,生成K2Li2FeO4。该电池的正极反应式为______________.
(16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是 。
已知:a.2CO(g)+ O2(g)==2CO2(g) △H =-566.0 kJ·mol-1
b.CH4(g)+2O2(g)==CO2(g)+2H2O(g) △H =-890.0 kJ·mol-1
则CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的热化学方程式为 。
(2)工业上合成氨气的反应为:N2(g)+3H2(g) 2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率( )与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
)与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= L2·mol-1。
②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
| HClO |
HSCN |
H2CO3 |
| K=3.2×10-8 |
K=0.13 |
Kl=4.2×10-7[来源 K2=5.6×10-11 |
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为 > > > 。
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为 。
③25℃时,为证明HClO为弱酸,某学习小组的同学没计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是 (填下列各项中序号)。
a.用pH计测量0.1 mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证睨HClO为弱酸
试题篮
()