(Ⅰ)A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题。

(1)已知常温下A为有色气体。若F是一种金属单质,写出B和适量F反应生成C与气体E的离子方程式_______________________;
(2)若A为双原子分子,C为直线型分子,E具有漂白性,物质F焰色反应呈黄色.则F的化学式为_____________________。
(3)若A为淡黄色固体,则A与水反应的化学方程式为_________________。
①若物质B和D的式量相等,D为淡黄色固体物质,C的大量排放往往会造成严重的环境问题即_______________。C与F反应的化学方程式为________________;
②若物质A和D的式量相等,D为白色絮状沉淀,写出C与F反应的离子方程式_________________________。
(Ⅱ)亚磷酸(H3PO3)是二元弱酸,与足量NaOH溶液反应,生成Na2HPO3。
(1)根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7(填“>”“<”或“=”)。常温下,向10mL0.01 mol·L-1H3PO3溶液中滴加10mL0.02 mol·L-1NaOH溶液后,溶液中各种离子浓度由大到小的顺序是_________ ;
(2)亚磷酸具有强还原性,可将Cu2+还原为金属单质,亚磷酸与硫酸铜溶液反应的方程式为______.
Ⅰ.请回答:
(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝。写出该反应的离子反应方程式: 。
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式: 。
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3)。现取适量这种钴的氧化物,可与480 mL 5 mol·L-1盐酸恰好完全反应,得到CoCl2溶液和6.72 L黄绿色气体(标准状况)。则该反应的化学反应方程式为 。
Ⅱ.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素。根据以下信息填空:
| 元素 |
相关信息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D |
室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E |
它在地壳中储量丰富,是人体不可缺少的微量元素之一。其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(4)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为 ;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是 。化合物Z仅由元素D和E组成, Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式: 。
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成 。
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互的转化关系如下图所示。请回答下列问题: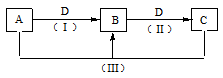
(1)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一.
①A中所含化学键类型为___________,D的电子式为___________;
②25℃时,0.1mol•L-1 B、C溶液,pH较大的是___________溶液(填溶质的化学式),写出B溶液中显电中性的原因___________,已知,B溶液里的pH=10,则其水电离出来的H+的浓度为________________。
(2)向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
I.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=-802.6kJ/mol
II.CH4(g)+O2(g)═CO2(g)+2H2(g)△H2=-322.0kJ/mol
III.CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.2kJ/mol
Ⅳ.CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H4=+165.0kJ/mol
请回答下列问题:
①CH4的燃烧热△H________△H1.(填“>”、“<”或“=”);
②在反应初始阶段,反应II的反应速率大于反应III的反应速率.比较反应II的活化能EII和反应III的活化能EIII的大小:EII________EIII(填“>”、“<”或“=”)。
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为 ,E的基态原子的电子排布式为 。
(2)由B、D形成的BD32-离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
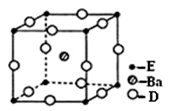
(4) D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。
(5)纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
(I)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式___________________________。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式______________。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式________________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式________________________。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式______________________________________________。
(II)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。已知:2SO2(g)+O2(g) 2SO3(g) ΔH ="-98.3" kJ·mol-1。
2SO3(g) ΔH ="-98.3" kJ·mol-1。
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
2 mol SO2、1 mol O2 |
2 mol SO3 |
m mol SO2、n mol O2、p mol SO3 |
| c(SO3) /mol·L-1 |
1.4 |
1.4 |
1.4 |
| 能量变化 |
放出a kJ |
吸收b kJ |
吸收c kJ |
| SO2或SO3的转化率 |
α1 |
α2 |
12.5% |
则:α1+α2=_________________,p=________________mol,b+c="_______________kJ" 。
(III)HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐 较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量)
较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量) A-+H2C- B.H2B(少量)+2A-
A-+H2C- B.H2B(少量)+2A- B2-+2HA
B2-+2HA
C.H2B(少量)+H2C- HB-+H3C
HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是_____________。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是_________,最难结合质子的是____________。
(3)完成下列反应的离子方程式HA(过量)+C3-:________________________________。
(IV)在25下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+) = c(Cl-),则溶液显______________(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=_____________。
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:

(1)相同条件下,pH相同的NH4Al(SO4)2中c(NH4+) (填“=”、“>” “<”)NH4HSO4中c(NH4+)。
(2)如图1是0.1mol•L﹣1电解质溶液的pH随温度变化的图象。
①其中符合0.1mol•L﹣1 NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②室温时,0.1mol•L﹣1 NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)= mol•L﹣1(填数值)
(3)室温时,向100mL 0.1mol•L﹣ 1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在c点,溶液中各离子[浓度由大到小的排列顺序是 。
如图所示的框图中,A~I都是由短周期元素组成的常见物质。其中A是气体,它的水溶液呈碱性;氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒;单质E可作半导体材料。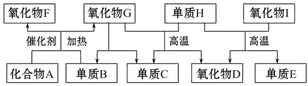
(1)化合物A的化学式是_______________________。
(2)组成单质E的元素在元素周期表中的位置是____________________________;
H+I反应的化学方程式为______________________________________。
(3)标准状况下,将2.24 L氧化物F和1.68 L单质B同时通入1 L氧化物G中(反应前后溶液体积的变化忽略不计),所得溶液的pH=___________。此时再向溶液中通入2.24 L化合物A,完全反应后所得溶液的pH<7,用离子方程式表示其原因:____________________________________。
(4)单质B和单质C在一定条件下可组成原电池(用KOH溶液作电解质),则该原电池负极的电极反应式为________________________________________________。
短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族;E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6。
(1)E在元素周期表中的位置是 。
(2)由A、C、F三种元素按原子个数比1∶1∶1组成的化合物与BA3反应生成B的单质, 写出该反应的化学方式 。
(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的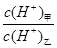 = ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
= ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
(4)用图所示装置电解由D与F形成盐的饱和溶液时,若阴、阳极都用铁作电极,则阳极的电极反应式为 ,溶液中出现的现象是 。
试题篮
()