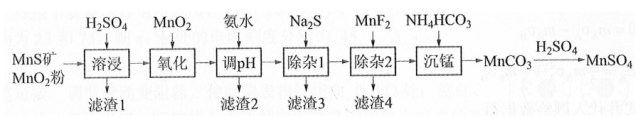
高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[ ]形成氢氧化物沉淀的pH范围如下:
| 金属离子 |
|
|
|
|
|
|
|
| 开始沉淀的pH |
8.1 |
6.3 |
1.5 |
3.4 |
8.9 |
6.2 |
6.9 |
| 沉淀完全的pH |
10.1 |
8.3 |
2.8 |
4.7 |
10.9 |
8.2 |
8.9 |
(1)"滤渣1"含有S和________;写出"溶浸"中二氧化锰与硫化锰反应的化学方程式________。
(2)"氧化"中添加适量的 的作用是将________。
(3)"调pH"除铁和铝,溶液的pH范围应调节为________~6之间。
(4)"除杂1"的目的是除去 和 , "滤渣3"的主要成分是________。
(5)"除杂2"的目的是生成 沉淀除去 。若溶液酸度过高, 沉淀不完全,原因是________。
(6)写出"沉锰"的离子方程式________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 , 其中Ni、Co、Mn的化合价分别为+2、+3、+4。当 时, z=________。
我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有  和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子  形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:

回答下列问题:
(1)焙烧过程中主要反应的化学方程式为________。
(2)滤渣1的主要成分出 外还有________;氧化除杂工序中ZnO的作用是________.若不通入氧气,其后果是________。
(3)溶液中的 可用锌粉除去,还原除杂工序中反应的离子方程式为________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为________;沉积锌后的电解液可返回________工序继续使用。
聚合硫酸铁(PFS)是水处理中重要的絮凝剂,如图是以回收废铁屑为原料制备PFS的一种工艺流程.
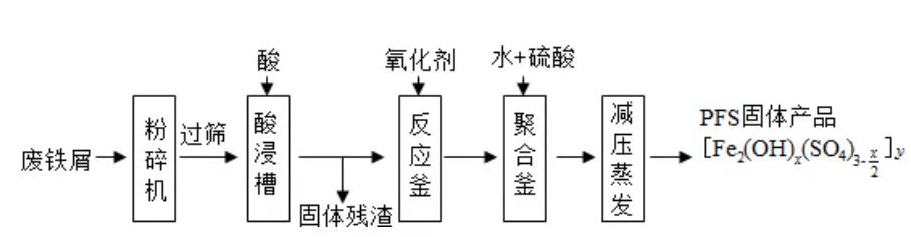
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为________.粉碎过筛的目的是________.
(2)酸浸时最合适的酸是________,写出铁锈与酸反应的离子方程式________.
(3)反应釜中加入氧化剂的作用是________,下列氧化剂中最合适的是________(填标号).
| A. |
|
B. |
|
C. |
|
D. |
|
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时 水解程度弱,pH偏大时则________.
(5)相对于常压蒸发,减压蒸发的优点是________.
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为 (n为物质的量).为测量样品的B值,取样品 ,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰).到终点时消耗NaOH溶液 .按上述步骤做空白对照试验,消耗NaOH溶液 ,已知该样品中Fe的质量分数w,则B的表达式为________.
硼酸
是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含
及少量
)为原料生产硼酸及轻质氧化镁的工艺流程如下:
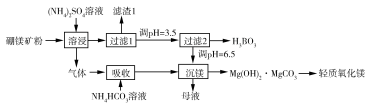
回答下列问题:
(1)在 "溶侵"硼镁矿粉,产生的气体在"吸收"中反应的化学方程式为_________。
(2)"滤渣1"的主要成分有_________。为检验"过滤1"后的滤液中是否含有 离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应: , ,可判断 是_______酸;在"过滤2"前,将溶液pH调节至3.5,目的是_______________。
(4)在"沉镁"中生成 沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
某化学兴趣小组做了Na2CO3的相关性质实验,请按要求回答问题:
第一步:称量10.6g Na2CO3固体全部溶于水中,配成100mL溶液;
第二步:量取5.0mL上述溶液于试管中,再滴加2滴酚酞溶液,观察到的现象是 ,请说明原因 (用离子方程式表示);
第三步:将第二步试管中的溶液均分成2份,一份微微加热,观察到的现象是 ,请说明原因: (用文字说明);另一份慢慢滴加1.0 mol/L CaCl2溶液,观察到的现象是 ;
第四步:再量取4mL Na2CO3溶液于干净的试管中,缓慢滴加1.0mol/L HCl溶液2mL,滴加过程中始终没有观察到气泡产生,请说明原因 (用离子方程式表示)。
某实验小组同学依据资料深入探究Fe3+在水溶液中的行为。
资料:
i.Fe3+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;
[Fe(H2O)6]3+发生如下水解反应:
[Fe(H2O)6]3+(几乎无色) + nH2O  [Fe(H2O)6-n(OH)n]3-n(黄色) + nH3O+(n = 0~6) ;
[Fe(H2O)6-n(OH)n]3-n(黄色) + nH3O+(n = 0~6) ;
ii.[FeCl4(H2O)2]-为黄色。
进行实验:
【实验I】

【实验II】
分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。

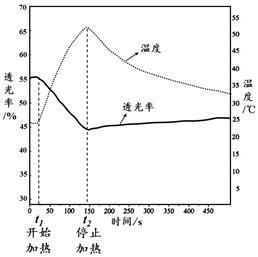
图1 图2
Fe(NO3)3溶液透光率随温度变化曲线 FeCl3溶液透光率随温度变化曲线
(1)实验I中,试管②溶液变为无色的原因是 。
(2)实验I中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是 。
(3)由实验II图1、2可知:加热时,溶液颜色 (填“变浅”、“变深”或“不变”)。
(4)由实验II,可以得出如下结论:
[结论一] FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]- + 4H2O 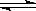 [Fe(H2O)6]3+ + 4Cl-,得出此结论的理由是 。
[Fe(H2O)6]3+ + 4Cl-,得出此结论的理由是 。
[结论二] 结论一中反应的ΔH (填“>0”或“<0”)。
(5)实验小组同学重新设计了一个实验证明(4)中结论一。实验方案:取试管①中溶液, (请描述必要的实验操作和现象)。
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,混合溶液中由水电离出的c(H+)_______0.2mol/LHCl溶液中由水电离出的c(H+)(填“>”、“<”、或“=”) 。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度__________MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将0.1mol/L的HR溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH_____________。(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 |
0.1032mol/L HCl溶液体积/mL |
待测NaOH溶液体积/mL |
| 1 |
27.83 |
25.00 |
| 2 |
26.53 |
25.00 |
| 3 |
27.85 |
25.00 |
①待测NaOH溶液的物质的量浓度为________________mol/L。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是____________。
A.酸式滴定管未用标准盐酸溶液润洗 B.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
C.锥形瓶未用待测液润洗 D.酸式滴定管滴定前平视读数,滴定后俯视读数
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
| 颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
| Ksp |
1.8×10﹣10 |
5.0×10﹣13 |
8.3×10﹣17 |
2.0×10﹣48 |
1.8×10﹣10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的_________________。
A.KBr B.KI C.K2S D.K2CrO4
(1)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:①气提、吸收CO2,用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。

②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymlHCl溶液,海水中溶解无机碳的浓度= mol/L。
(2)室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为 。
已知: H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是_________;
(2)浓度均为0.10mol•L-1的莫尔盐溶液和FeSO4溶液,c(Fe2+)前者______后者.(填“大于”、“小于”或“等于”或“无法判断”)
(3)0.10mol•L-1莫尔盐溶液中离子浓度由大到小的顺序为_________;
(4)常温下,若0.10mol•L-1(NH4)2SO4溶液的pH=5,求算NH3•H2O的电离平衡常数Kb≈________;
《化学反应原理》一书中,我们学习了两个重要的定量实验。请回答下列问题:
I.某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol·L-1盐酸、0.55mol·L-1 NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
| 实 验 试剂如下 |
溶 液 温 度 |
中和热 △H |
||||
| t1 |
t2 |
|||||
| ① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
|
| ② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
||
已知:Q(放)="C" m(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1·Kg-1,m指溶液的质量,各物质的密度均为1g·cm-3。
①计算分析△H= 。(结果保留3位有效数字)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
II.为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为
(2) 完成并配平下列离子方程式
C2O42- + MnO4- + H+ = CO2 + Mn2+ +
(3) 步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(4) 步骤③中判断滴定终点的方法是 。
(5)常温下0.01 mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示
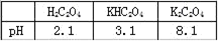
①写出H2C2O4的电离方程式_________ __________________。
②KHC2O4溶液显酸性的原因是 (请用方程式并结合必要的文字回答该小题) _______________
③向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______。
A.c K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-)
B.c(Na+) = c(H2C2O4) + c(C2O42-)
C.c(K+) + c(Na+) = c(HC2O4-) + c(C2O42-)
D.c(K+) > c(Na+)
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
注:NH4Fe(SO4)2是一种复盐。请回答下列问题:
(1)TiCl4水解生成TiO2·x H2O的化学方程式为_________________________。
(2)检验TiO2·x H2O中Cl-是否被除净的方法是_________________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是______________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_______(填字母代号)。
(4)滴定终点的现象是__________________________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗C mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为___________________。
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果__ __。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
碱式硫酸铁[Fe(OH)SO4]可用作净水剂、媒染剂、颜料和药物。工业上利用废铁屑(含少量氧化铝、氧化铁等),生产碱式硫酸铁的部分工艺如下: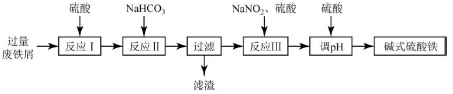
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表: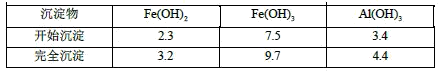
(1)反应I中发生的氧化还原反应的离子方程式是__________。
(2)反应II中加入NaHCO3调节体系的pH在____范围内。
(3)反应III中生成的气体遇空气变红棕色,则III中发生反应的离子方程式是_________ 。
(4)反应III中通入氧气可减少NaNO2的用量,若消耗1mol氧气可节约n(NaNO2)=____mol。
(5)用硫酸可知体系的pH。若硫酸加入量过小,溶液生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理分析其原因是_________。
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可发生水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式是____________。
(本题14分)
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题:
(1).氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板____________________________。
(2).吸收剂X的化学式为 ;氧化剂Y的化学式为________________。
(3).碱性条件下反应①的离子方程式为____________________________________。
(4).过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为
2KOH+Na2FeO4→K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_________。
(5).K2FeO4在水溶液中易发生反应:4FeO42+10H2O 4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
| A.H2O | B.稀KOH溶液、异丙醇 |
| C.NH4Cl溶液、异丙醇 | D.Fe(NO3)3溶液、异丙醇 |
(6).可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42-+CrO2-+2H2O→CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+→Cr2O72-+H2O
③Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为 。(答案用小数表示,保留3位小数)
工业废渣、废水回收利用是重要研究课题。下面流程是生产食用香料正丁酸乙酯的工厂废水(含乙醇、正丁酸乙酯、正丁酸、乙醚和大量无机悬浮物)联合利用电子工业废料(含SiO2和Cu2(OH)2CO3)回收铜的工艺设计。
回答下列问题:
(1)初沉加入的试剂是明矾,写出参与净水的离子的水解方程式: 。
(2)固体X的成分是 ,反应I的化学反应方程式 。
(3)试剂Y为 ;加快反应II速率的措施有(任写一条) 。
(4)反应Ⅲ的离子方程式为: 。
(5)硅胶在生活与生产中用途广泛,写出其中一种用途 。
某学生对Na2SO3与AgNO3在不同PH下的反应进行探究。
(1)测得Na2SO3溶液PH=11,AgNO3溶液PH=5,二者水解的离子分别是 。
(2)调节PH,实验记录如下:
查阅资料得知:
i.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
ii.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将中滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据上述现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如下:
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。
试题篮
()