右图A→E是五种中学化学常见物质其中A、B、C、D常温下都是气体,B 为红棕色,A为气体单质。
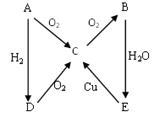
(1)写出化学式:B C
(2)实验室制备D实验中所用的干燥剂是: 。
(3)B与H2O反应,该反应的氧化剂和还原剂的物质的量之比为 。
(4)A与O2的反应方程式: ;D与O2的反应方程式:
;A与H2的反应方程式: 。
NO、NO2、NH3、SO2、CO等都是空气污染物。
(1)酸雨的形成主要是大气中的_________溶于水后形成了酸性溶液。
(2)在汽车的排气管上装一个催化转化装置,可使汽车尾气中的NO与CO反应,生成氮气和碳的另一种无污染的气体,请完成该转化的化学方程式: NO + CO—N2+ 。
下列叙述错误的是( )
| A.检验NH时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 |
| B.液氨汽化时要吸收大量的热,可用作制冷剂 |
| C.实验室用NH4Cl和Ca(OH)2制备NH3涉及氧化还原反应 |
| D.将分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
制取氨气并完成喷泉实验
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要制取干燥的氨气可选用 做干燥剂。
(3)如图进行喷泉实验,上部烧瓶已装满干燥的氨气,引发水上喷的操作是 ,该实验的原理是
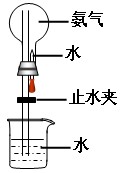
(4)反应后,烧瓶内的溶液中含有的微粒为 。
锌与很稀的硝酸反应生成Zn(NO3)2、NH4NO3和水。当生成1mol硝酸锌时,被还原的硝酸的物质的量为( )
| A.0.25mol | B.0.5mol | C.1mol | D.2mol |
将含有少量杂质的硝酸铜固体用酒精灯加热至恒重,收集到20.20 mL气体,再将该气体用足量水吸收,剩余2.10 mL气体(气体体积在同温同压下测定),则关于杂质成分的推测不合理的是
| A.NaNO3 | B.Mg(NO3)2 |
| C.AgNO3 | D.NaNO3和AgNO3的混合物 |
下列事实,可以证明氨水是弱碱的是
| A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 |
| B.铵盐受热易分解 |
| C.0.1mol/L的氨水可以使酚酞试液变红 |
| D.0.1mol/L的NH4Cl溶液的pH约为5 |
下列说法正确的是
| A.铵盐不稳定,受热分解都产生氨气 |
| B.N2是空气中的主要成分之一,雷雨时可直接转化为NO2 |
| C.由于浓硫酸有强氧化性,因此不能用铁罐贮存浓硫酸 |
| D.Cl2与石灰乳反应可以制得含氯漂白剂 |
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体,现将此无色混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色,对于原混合气体成分的判断中正确的是
| A.肯定有NO和NO2 | B.肯定有SO2和NO |
| C.可能有Cl2和O2 | D.肯定没有Cl2、NO2,可能有O2 |
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| |
X. |
Y |
Z |
| ① |
NaOH溶液 |
Al(OH)3 |
稀硫酸 |
| ② |
KOH溶液 |
SiO2 |
浓盐酸 |
| ③ |
O2 |
N2 |
H2 |
| ④ |
FeCl3溶液 |
Cu |
浓硝酸 |
A.①③ B.①④ C.②④ D.②③
下列反应起到了氮的固定作用的是( )
| A.N2和H2在一定条件下反应生成NH3 |
| B.NO和O2反应生成NO2 |
| C.NH3经催化氧化生成NO |
| D.由NH3制碳铵(碳酸氢铵)和硫铵(硫酸铵) |
下列有关氮元素及其化合物的表示正确的是
A.质子数为7、中子数为8的氮原子: |
B.溴化铵的电子式: |
C.氮原子的结构示意图: |
D.间硝基甲苯的结构简式: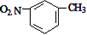 |
试题篮
()