NO、NO2、O2按照一定比例通入水中,能被完全吸收,无剩余气体,若NO、NO2、O2的气体体积分别为a、b、 c、则a:b:c可能为
| A.1:5:2 | B.2:5:1 | C.5:1:2 | D.5:2:1 |
某金属的硝酸盐加热分解生成NO2和O2的分子数之比为 4:1。在加热分解过程中,该金属元素
| A.无法确定 | B.化合价不变 | C.化合价升高 | D.化合价降低 |
下列叙述正确的是(用NA代表阿伏加德罗常数的值)
| A.1 mol·L-1NaCl溶液含有NA个Na+ |
| B.1 L 0.1 mol·L-1氨水含有0.1 NA个OH- |
| C.电解饱和食盐水若产生2 g氢气,则转移2 NA个电子 |
| D.将0.1 mol氯化铝溶于1 L水中,所得溶液含有0.1 NA个Al3+ |
下图是用点滴板探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板。下列对实验现象的解释正确的是

| 选项 |
实验现象 |
解释 |
| A |
红色石蕊试纸变蓝 |
NH3极易溶于水 |
| B |
浓硫酸附近无白烟 |
NH3与浓硫酸不发生反应 |
| C |
氯化铝溶液变浑浊 |
NH3与AlCl3溶液反应:Al3++3OH–→Al(OH)3↓ |
| D |
浓盐酸附近有白烟 |
NH3与挥发出的HCl反应:NH3+HCl→NH4Cl |
38.4g铜跟一定量的浓硝酸反应,铜全部作用后共收集到混合气体22.4L(标准状况下),反应消耗的硝酸的物质的量为( )
| A.1mol | B.1.6 mol | C.2.2 mol | D.2.4 mol |
在一定条件下,将等体积的NO和NO2充入试管,并将试管倒立于水槽,充分反应后剩余气体的体积缩小为原体积的
| A.1/2 | B.1/3 | C.3/8 | D.2/3 |
下列有关实验操作、现象、解释和结论都正确的是( )
| |
操 作 |
现 象 |
解释、结论 |
| A |
把过量的Fe粉中加入硝酸中充分反应,滴入KSCN溶液 |
溶液呈红色 |
稀硝酸将Fe氧化为Fe3+ |
| B |
向饱和Na2CO3溶液中通入足量CO2 |
溶液变浑浊 |
析出了Na2CO3晶体 |
| C |
Al箔插入稀硝酸中 |
无现象 |
Al在硝酸中钝化,形成致密的氧化膜 |
| D |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上 |
试纸变蓝色 |
浓氨水呈碱性 |
下列事实,可以证明氨水是弱碱的是
| A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 |
| B.铵盐受热易分解 |
| C.0.1mol/L的氨水可以使酚酞试液变红 |
| D.0.1mol/L的NH4Cl溶液的pH约为5 |
下列说法正确的是
| A.铵盐不稳定,受热分解都产生氨气 |
| B.N2是空气中的主要成分之一,雷雨时可直接转化为NO2 |
| C.由于浓硫酸有强氧化性,因此不能用铁罐贮存浓硫酸 |
| D.Cl2与石灰乳反应可以制得含氯漂白剂 |
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体,现将此无色混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色,对于原混合气体成分的判断中正确的是
| A.肯定有NO和NO2 | B.肯定有SO2和NO |
| C.可能有Cl2和O2 | D.肯定没有Cl2、NO2,可能有O2 |
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| |
X. |
Y |
Z |
| ① |
NaOH溶液 |
Al(OH)3 |
稀硫酸 |
| ② |
KOH溶液 |
SiO2 |
浓盐酸 |
| ③ |
O2 |
N2 |
H2 |
| ④ |
FeCl3溶液 |
Cu |
浓硝酸 |
A.①③ B.①④ C.②④ D.②③
下列反应起到了氮的固定作用的是( )
| A.N2和H2在一定条件下反应生成NH3 |
| B.NO和O2反应生成NO2 |
| C.NH3经催化氧化生成NO |
| D.由NH3制碳铵(碳酸氢铵)和硫铵(硫酸铵) |
下列有关氮元素及其化合物的表示正确的是
A.质子数为7、中子数为8的氮原子: |
B.溴化铵的电子式: |
C.氮原子的结构示意图: |
D.间硝基甲苯的结构简式: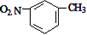 |
试题篮
()