亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:
【实验I】制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3
设计制备装置如下(夹持装置略去):
(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为 。
(2)如果没有B装置,C中发生的副反应有 。
(3)甲同学检查完装置气密性良好后进行实验,发现NaNO2的纯度较低。乙同学对上述装置进行适当改进后提高了NaNO2的纯度,其改进措施是 。
(4)丙同学对B中的药品进行了更换,也提高了NaNO2的纯度。丙更换的药品最好是 。
【实验Ⅱ】测定甲、乙同学制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶:
b.分别称量0.10 g甲、乙制得的样品溶于水配成500 mL溶液,贴上标签甲、乙。再分离别取5 mL甲、乙待测液,各加入1 mL M溶液,均加蒸馏水至10 mL振荡,分别与标准色阶比较。
(5)步骤b中比较结果是:甲待测液颜色与③号色阶相同,乙待测液颜色与④号色阶相同。则甲同学制得的样品中NaN02的纯度是 %。
(6)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。
已知SO2可以用Fe(NO3)3溶液吸收,某学习小组据此按下图装置展开如下相关探究:取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热。装置A中有白雾(硫酸酸雾)生成, 装置B中产生白色沉淀。
回答下列问题:
(1)装置A中用于添加浓硫酸的仪器名称为 ;检查图中连通装置A、B气密性的方法是 。
(2)加入浓硫酸之前先通人N2一段时间,其目的是 ;排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是 。若用氢氧化钠溶液处理尾气,则发生反应的离子方程式为 。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置B中参与了反应。
假设2: 。
假设3:Fe(NO3)2溶液显酸性,在此酸性条件下NO3‾能氧化SO2。
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
| 实验步骤(简述操作过程) |
预期现象和结论 |
| ①测1.0mol•L‾1Fe(NO3)3溶液的pH; ② ③ ④ |
|
某溶液中可能含有 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是
等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是
A.原溶液中一定含有的阳离子是 |
| B.原溶液中一定含有SO42-和Na+ |
| C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| D.反应最后形成的溶液中含有的溶质仅为Na2SO4 |
(本题共14分)工业上用氨气与空气混合,通过“氨的催化氧化”等反应工业合成硝酸及其他产品。将NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为_________________,若所得硝酸密度为ρg/cm3,则其物质的量浓度为 (保留两位小数)。
某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为 m3(保留两位小数)。
一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体。测出混合气体密度是同温同压下氢气的28倍。再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定)。计算混合气体中NO2的体积分数。
合成氨原料气由CH4在高温下与水蒸气、空气反应而得。反应原理如下:
CH4+2H2O→CO2+4H2 2CH4+O2+2H2O→2CO2+6H2
将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2。为使进入合成氨反应塔两者体积比为1∶3。计算起始气体中CH4和空气的比例。(已知空气中O2和N2的体积比为1∶4)。
1902年德国化学家哈博研究出合成氨的方法,其反应原理为:
N2(g)+3H2(g) 2NH3(g);△H(△H<0)
2NH3(g);△H(△H<0)
一种工业合成氨的简易流程图如下:
完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生。NH4HS的电子式是___________,写出再生反应的化学方程式:__________________。NH3的沸点高于H2S,是因为NH3分子之间存在着一种比_________力更强的作用力。
(2)室温下,0.1 mol/L的氯化铵溶液和0.1 mol/L的硫酸氢铵溶液,酸性更强的是_______,其原因是___________________________________________________________。
已知:H2SO4:H2SO4 = H++HSO4-;
HSO4- H++SO42- :
H++SO42- :
K =1.2×10-2 NH3·H2O:K=1.8×10-5
(3)图甲表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______(保留3位有效数字)。
(4)依据温度对合成氨反应的影响,在图乙坐标系中,画出一定条件下的密闭容器内,从常温下通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法(只答一种即可):_________________。
含氮化合物是重要的化工原料。存在如下转化关系:
(1)工业上常用浓氨水检验氯气管道是否泄漏。
①氨气溶于水的过程中存在的平衡有 (用离子方程式表示)。
②向固体氧化钙中滴加浓氨水,可用于实验室制取少量氨气,简述原理 。
(2)转化Ⅱ中发生的系列反应,在工业上可以用来制备硝酸,写出①中反应的化学方程式为 。
(3)现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱。转化Ⅲ中部分反应如下:
NH3+CO2+H2O  NH4HCO3,NH4HCO3+NaCl(饱和)
NH4HCO3,NH4HCO3+NaCl(饱和) NaHCO3↓+NH4Cl。
NaHCO3↓+NH4Cl。
①转化Ⅲ中有NaHCO3沉淀析出的原因是 。
②欲测定某工业纯碱样品中Na2CO3的质量分数,某同学设计方案如下:
准确称取10.00g样品,加入过量的盐酸,充分反应,蒸干、冷却后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。样品中碳酸钠的质量分数为 。
(4)以氨作为燃料的固体氧化物(含有O2一)燃料电池,具有全固态结构、能量效率高、无污染等特点。工作原理如图所示:
①固体氧化物作为电池工作的电解质,O2一移向 (填字母)。
A.电极a B.电极b
②该电池工作时,电极a上发生的电极反应为 。
(本题14分)
烟气中NOx是NO和NO2的混合物(不含N2O4)。
(1).根据废气排放标准,1m3烟气最高允许含400mgNOx。若NOx中NO质量分数为0.85,则lm3烟气中最高允许含NO L(标准状况,保留2位小数)。
(2).若用氨气除去废气中的氮氧化物(NOx):NOx+NH3→N2+H2O(l)。假如每升废气中含NOx 0.0672L(只含NO和NO2),向100.000L废气中通入10.000L氨气可使NOx完全转化,测得反应后气体体积变为103.952L(气体体积均折算到标准状况)。
①NOx 中的 x 值为_________(保留1位小数)。
②除去废气中的NOx,至少需氨________mol(保留2位小数)。
(3).工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度l.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为 mol/L(保留2位小数)。
(4).已知:NO+NO2+Na2CO3 → 2NaNO2+CO2 ①
2NO2+Na2CO3 → NaNO2+NaNO3+CO2 ②
1m3含2000mgNOx的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气 排放标准(填“符合”或“不符合”), 理由: 。
(5).加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3 → 3NO2+H2O
当烟气中n(NO):n(NO2)=2:3时,吸收率最高。
lm3烟气含2000mgNOx,其中n(NO):n(NO2)=9:1。
计算:
①为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数)。
②1m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)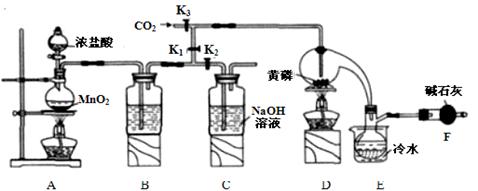
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5,PCl3遇水会强烈水解生成 H3PO3和HCl。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,E中冷水的作用是 F中碱石灰的作用是_____。
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先___________ ,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)若去掉装置B,则导致测定结果 (填“偏高”、“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】按以下步骤测定样品中A1N的纯度:
(4)步骤②生成沉淀的离子方程式为___________________。
(5)步骤③的操作是 。A1N的纯度是 (用m1、m2表示)。
“三酸二碱”在化工生产中有着重要的应用。下列说法正确的是
| A.在沸腾炉和接触室中,均使用过量的高压空气,以提高硫铁矿的燃烧利用率和二氧化硫的催化氧化转化率 |
| B.上图是工业制盐酸的设备及其简易图 |
| C.氯碱工业是中国现代化工之母,其主要反应是电解海水,得到烧碱和氯气,因此称为氯碱工业 |
| D.合成氨工业是工业制硝酸和工业制纯碱的前提和保证,前者可为后两者共提供了不止一种原料 |
(14分)肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
CO(NH2)+2NaOH+NaClO = Na2CO3+N2H4·H2O+NaCl
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是 ;
实验二:制取水合肼(实验装置如图所示)
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114 ℃馏分。(已知:N2H4·H2O+2NaClO = N2↑+3H2O+2NaCl)
(2)分液漏斗中的溶液是 (填标号A或B);
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是 ;
实验三:测定馏分中肼含量
水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000 g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250 mL溶液。
b.移取25. 00 mL于锥形瓶中,加入10 mL水,摇匀.
c.用0.2000 mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式 ;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 ;
(4)滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”) ;若本次滴定消耗碘的标准溶液为18.00 mL,馏分中水合肼(N2H4·H2O)的质量分数为 (保留三位有效数字);
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是: 。
(共8分)将44.8g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L请回答:
(1)标况下,NO的体积为______L,NO2的体积为_______L。
(2)待产生的气体全部释放后,向溶液中加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为___________mol/L(填表达式)。
(3)欲使铜与硝酸反应生成的气体与O2和H2O全部转化为HNO3,至少需要O2_________g。
某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是
| A.NO2 | B.NO | C.N2O | D.N2 |
氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。为探究氨气的性质,某研 究性学习小组做了以下实验:
(1)实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气。)
①实验室制取氨气的化学方程式为 。
②若用加热碳酸氢铵固体制取纯净的氨气,你认为装置B的作用是 。
(2)在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有 性。
(3)某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O。
已知:①Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+。
②在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2。
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O。(简述操作方法、现象和结论)
(4)现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。
下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀)===6Cu(NO3)2 + 2NO↑+ 7H2O】___________
| A.加入NaOH溶液的体积为1.2L |
| B.Cu和Cu2O混合物质量为27.2g |
| C.混合物完全溶解后溶液中n(H+)=0.3mol |
| D.将等质量混合物完全还原至少需标准状况下H21.12L |
【改编】某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
下列有关推断合理的是
| A.根据上述连续实验不能确定溶液X中是否含有Fe3+ |
| B.沉淀H为Al(OH)3、BaCO3的混合物 |
| C.溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- |
| D.若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)="0.05" mol·L-1 |
试题篮
()