下列各表述与示意图不一致的是
A.图①表示向含Mg2+、Al3+、 的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+) :n(Al3+) :n( 的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+) :n(Al3+) :n( )=2 :1 :2,其中使用的NaOH的浓度为2 mol·L-1。 )=2 :1 :2,其中使用的NaOH的浓度为2 mol·L-1。 |
| B.图②中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)时,△H<0,若使用正催化剂,E值会减小。 |
| C.图③可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
| D.图④表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图 |
下图是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先____,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹l,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时还可能产生的现象是________;从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16 g,反应后称重固体质量减少2.4 g,通过计算确定该固体产物的成分是________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。请写出产生白烟的化学方程式:________,迅速产生倒吸的原因是________。
(6)为了汪明一水合氨是弱碱,甲、乙两同学分别设计以下实验进行探究。
①甲同学用pH试纸测得室温下0.l mol/L氨水pH为10,则认定一水合氨是弱电解质,理由是________。
②乙同学取出10 mL 0.1 mol/L氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是________,则证明一水台氨是弱电解质。
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:
①2NO + Na2O2 = 2NaNO2
②2NO2 + Na2O2 = 2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+。
Ⅰ.产品制备与检验:用如下装置制备NaNO2: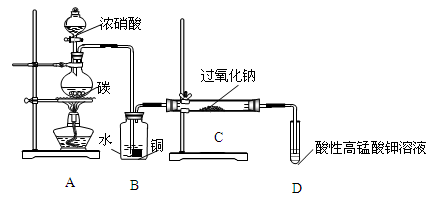
(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移
的方向和数目 。
(2)B装置的作用是 。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在框内画出增加的装置图,并标明盛放的试剂。
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论) 。
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 |
1 |
2 |
3 |
4 |
| KMnO4溶液体积/mL |
20.60 |
20.02 |
20.00 |
19.98 |
(5)第一组实验数据出现异常,造成这种异常的原因可能是 (双项选择)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数 。
(结果保留4位有效数字)
(14分)某研究性学习小组研究HNO3的氧化性,设计了如下实验:
在盛有新制FeSO4溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴入几滴浓HNO3,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色快速变为蓝色,并产生红棕色气体,这一奇特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
(1)甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是______________________________________________。
(2)乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原,推测可能是KSCN与HNO3作用。KSCN溶液是一种无色液体,根据C、S、N的原子结构和共价键的相关知识推测SCN-中碳原子的杂化轨道类型是_______杂化。
(3)根据乙同学的观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀,写出向浓HNO3中滴入KSCN的离子方程式______________________________。
(4)丙同学认为SCN-的性质还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均消失变为黄色,而加入碘水时溶液的颜色基本不变。丙同学的设计意图是____________。
(5)通过本次探究,可以得出以下结论:
a、用SCN-间接检验Fe2+时应注意__________;
b、与SCN-反应使溶液变红的______是Fe3+。
(13分)下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。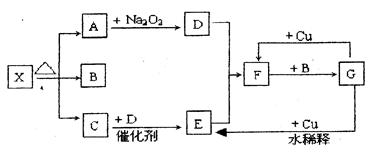
(1)写出下列各物质的化学式:
X: ;B: ;F: ;G: 。
(2)写出下列变化的反应方程式:
A→D: ;G→E: 。
(3)实验室里,常用加热 的混合物的方法制取气体C,常采用 法来收集,可否用无水CaCl2干燥气体C (填“否”或者“可以”)。
将3.2g铜与过量硝酸(8mol/L,30ml)充分反应后,硝酸的还原产物为NO2和NO ,反应后溶液中含a mol H+,则此溶液中所含NO3-的物质的量为
| A.(0.2+a)mol | B.(0.1+a)mol | C.(0.05+a)mol | D.amol |
以下是氮循环的一部分:
(1)通常状况下,NO2的颜色是 ;
(2)反应①的化学方程式是 ;
(3)NO2易溶于水,并和水发生化学反应。该反应中,氧化剂是 ;
(4)化合物A的化学式是 ;
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:
2NO + 2CO = 2CO2 + N2。当生成2mol N2时,被还原的NO为 mol。
某化学探究小组拟用废铜屑制取Cu(NO3)2:,并探究其化学性质。
I.如图,用浓HNO3,和过量的废铜屑充分反应制硝酸铜溶液。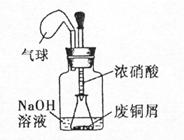
(1)写出铜与浓硝酸反应的离子方程式 。
(2)①装置中NaOH溶液的作用是 。
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤是蒸发浓缩、 、过滤。
③你认为此装置是否合理,并说明原因 。
如果不合理,同时在原装置上改进;如果合理,只需说明原因。
Ⅱ.为了探究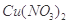 的热稳定性,探究小组按下图装置进行实验。(图中铁架台、铁夹和加热仪器均略去)
的热稳定性,探究小组按下图装置进行实验。(图中铁架台、铁夹和加热仪器均略去)
【实验装置】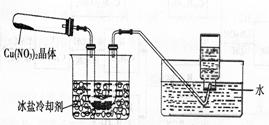
【实验操作及现象】往试管中放人研细的无水Cu(NO3)2:晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在集气瓶中收集到无色气体。
【解释与结论】
(3)①红棕色气体是 。
②根据现象判断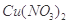 在加热条件下可以分解,其化学反应方程式为 。
在加热条件下可以分解,其化学反应方程式为 。
Ⅲ.利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3·Cu(OH)2]。
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品。
【实验数据】反应温度对样品的影响
| 实验序号 |
1 |
2 |
3 |
4 |
| 温度/℃ |
35 |
50 |
70 |
95 |
| 样品颜色 |
深蓝色 |
深蓝色 |
浅绿色 |
暗蓝色 |
| 样品中碱式碳酸铜 的质量分数/% |
90.9 |
92.7 |
x |
92.0 |
(4)滤液中可能含有 ,写出检验
,写出检验 的方法 。
的方法 。
(5)95℃时,样品颜色发暗的原因:____ 。
(6)70C时,实验得到2.38 g样品,取此样品加热至分解完全(杂质不分解),得到1.76 g固体,此样品中碱式碳酸铜的质量分数是 。
Ⅰ.已知A是一种金属,B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟。A、B、C、D、E、F间有如下变化关系:
(1)B→D反应的化学方程式为 。
(2)F在空气中遇水蒸气产生白雾现象,这白雾实际上是 。
Ⅱ.已知X、Y为有刺激性气味的气体,有以下转化关系,部分产物未标出。
试回答:
(1)写出下列物质的化学式Y________、C________。
(2)反应①的离子方程式为____________,反应②的离子方程式为_______________。
(6分)将23.9 g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100 mL一定浓度的硝酸中,充分反应后,硝酸被还原成NO2和NO,反应后溶液中H+的物质的量为0.160 mol。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到29.4 g蓝色固体。
(1)铜片中单质铜的质量分数为__________。
(2)铜片与硝酸充分反应后,溶液中NO3-的物质的量浓度(假设反应前后溶液的体积不变)为_______。
已知:(1)A为正盐。(2)常温、常压下,B、C、D、E、G、H、I均为气体,其中D、G、H为单质,H为黄绿色气体,I通常为红棕色气体。(3)F在常温下是一种无色液体。(4)C、J的水溶液是一种酸。图中部分反应条件及产物已略去。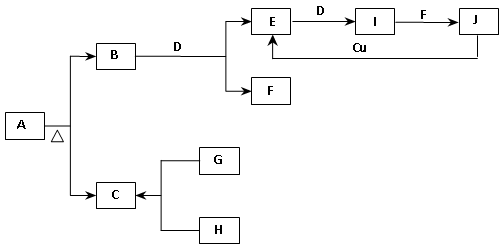
(1)写出A的化学式:A 。
(2)写出下列反应的化学方程式:
①B + D → E + F : ;
②J + Cu → E: ;
③H和石灰乳的反应: 。
(3)在I和F的反应中,氧化剂和还原剂的质量比为: 。
下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。
(1)下列叙述中正确的是(填序号) 。
| A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越小。 |
| B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已。 |
| C.硝酸的浓度越大,还原产物中N元素低化合价产物越少。 |
| D.当硝酸密度大于1.3 g·cm-3时,还原产物主要为NO、NO2 |
(2)当硝酸溶液的密度为1.36 g·cm-3时,Fe与过量硝酸反应的化学方程式是_________________。
(3)限用下列仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(不考虑N2O4)。设计一个合理而简单的实验方案(仪器可选择使用,N2的用量可自由控制,加热装置和固定装置省略)。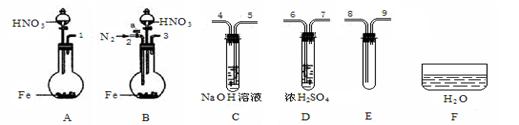
第1步:反应并收集生成的气体:
①实验中气体发生装置应选择 (填装置序号),理由是 。
②装置的连接顺序是(填各装置接口的序号):[ ]→[ ] [ ]→[8] [9]→[ ]。
③检查装置气密性后,开始反应。待E中充满红棕色气体,停止实验。
第2步:验证E中有NO。
④取下试管E,倒立在F中,轻轻摇动试管。
确认生成的气体中有NO的现象是 。
(4)某工厂生产硝酸的流程简要表示如下:
①氧化炉中反应的化学方程式为_____________________________________________________。
②工业上通常用质量分数为15%的Na2CO3水溶液(密度1.16 g·mL-1)作为NOx吸收剂,它的物质的量浓度为_____________ mol·L-1(保留2位小数)。
氨气是重要的化工原料。
38.实验室可用浓氨水和_____(选填编号)来制取氨气。
a.烧碱 b.生石灰 c.氯化铵
检验氨气易溶于水的简单操作是:收集一试管氨气, 。
39.往饱和食盐水中依次通入足量的NH3和足量的CO2,生成沉淀的化学式为 ;过滤后,使余液尽可能析出较多NH4Cl晶体的方法是:再通入足量的NH3、冷却并加入 。
侯德榜制碱法(联合氨碱法)的CO2来自_____(选填编号)。
a.石灰石煅烧 b.含碳物质燃烧 c.合成氨厂的副产品
40.往CuSO4溶液中滴加氨水,先有沉淀析出,后沉淀溶解溶液呈深(绛)蓝色,有[Cu(NH3)4]2+生成。往溶液中滴加稀硫酸,溶液变为淡蓝色。颜色变浅的主要原因可能是:
①溶液变稀;
②[Cu(NH3)4]2++4H+ Cu2+ + 4NH4+
Cu2+ + 4NH4+
请设计一个简单实验说明溶液变浅的主要原因 。
41.某实验小组设计了下列装置进行氨的催化氧化实验。

(1)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因可用化学方程式表示为: 、 。
(2)实验前,烧杯中盛有200mL 1.000 mol/L NaOH溶液,实验后将烧杯中溶液蒸干,再将所得固体加热至恒重,得到固体10.9g,则该固体含NaOH g。
【化学——选修2:化学与技术】(15分)
Ⅰ.合成氨工业的主要反应为:N2(g) + 3H2(g) 2NH3(g) △H<O,下图是合成氨的简要流程示意图:
2NH3(g) △H<O,下图是合成氨的简要流程示意图: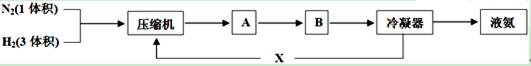
(1)沿X路线进入压缩机的物质是 。
(2)氮、氢混合气体送入合成塔前要通过压缩机压缩的原因是 ;
(3)下图为氨合成塔,为什么原料气从塔底流经外筒环隙进入,气体在反应前后都要通过热交换器?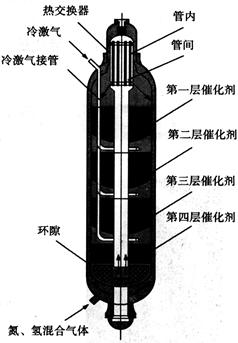
Ⅱ.氨是一种重要的化工原料,能制备氮肥、硝酸和纯碱等。
(1)我国化学家侯德榜改革国外的纯碱生产工艺,采用联合制碱法,生产流程可简要表示如下: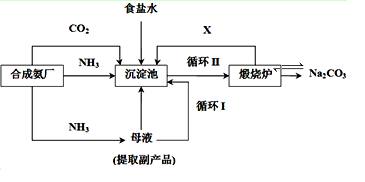
①写出上述流程中X物质的分子式 。
②沉淀池中发生的化学反应方程式是 。
③向母液中通入氨气,加入细小食盐颗粒,冷却析出副产品,通入氨气的作用有 。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(2)某工厂用氨制硝酸,再进一步制NH4NO3。已知由NH3制HNO3时产率为88%,由NH3被HNO3的吸收率为98%。则该工厂用100吨氨最多能制硝酸铵 吨。
某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装置。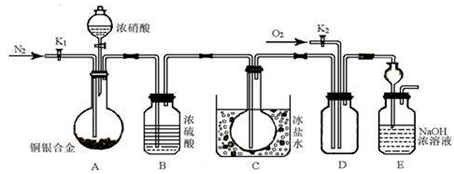
请回答下列问题
(1)写出A中Cu与HNO3反应可能的化学方程式 。
(2)实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 。
(4)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是 。
(5)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L1;实验后A溶液:V=40mL c(H+)=1.0 mol·L1。假设反应中HNO3既无挥发也无分解,则:参加反应的HNO3的物质的量
为 mol。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。请利用A装置中反应后的溶液进行简单的操作,以确定合金中Cu的质量分数,其实验过程为 。
试题篮
()