拟用下图装置制取如下表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热,a、b、c、d表示相应仪器中加入的试剂)。能达到实验目的的是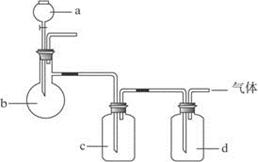
| 选项 |
气体 |
a |
b |
c |
d |
| A |
SO2 |
硫酸 |
亚硫酸钠 |
浓硫酸 |
NaOH溶液 |
| B |
NH3 |
浓氨水 |
消石灰 |
浓硫酸 |
H2O |
| C |
O2 |
双氧水 |
MnO2 |
H2O |
浓硫酸 |
| D |
Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓硫酸 |
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
| |
现 象 |
解 释 |
| A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
| B |
浓HNO3在光照条件下变黄 |
浓HNO3不稳定,生成棕色NO2能溶于浓硝酸 |
| C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO42- |
| D |
向盐酸中加入浓硫酸时产生白雾 |
说明浓硫酸具有脱水性 |
氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3¯,两步反应的能量变化示意图如下:

下列说法合理的是:
| A.该反应的催化剂是NO2¯ |
| B.升高温度,两步反应速率均加快,有利于NH4+转化成NO3¯ |
| C.在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态 |
| D.1 mol NH4+在第一步反应中与1 mol NO2-在第二步反应中失电子数之比为1:3 |
0.44 g铜镁合金完全溶解于100 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体336 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到0.78 g沉淀。下列说法正确的是
| A.该合金中铜与镁的质量量之比是2∶1 |
| B.该浓硝酸中HNO3的物质的量浓度是7.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到0.78 g沉淀时,加入NaOH溶液的体积是1380mL |
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确是
| A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况) |
| B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL |
| C.原稀硝酸的物质的量浓度一定为4 mol/L |
| D.参加反应金属总质量(m)为9.6g>m>3.6g |
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。下列说法不正确的
A.a点的溶液呈酸性的原因为:NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
| B.c点沉淀的质量比a点沉淀的质量大 |
| C.b点加入Ba(OH)2溶液的体积为150 mL |
| D.至c点完成反应,反应的离子方程式可表示为: |
Al3++2SO42-+NH4++2Ba2++5OH-= AlO2-+2BaSO4↓+NH3·H2O+2H2O
已知反应:2NO2+2NaOH=NaNO3+NaNO2+H2O ;NO+NO2+2NaOH=2NaNO2+H2O。现有XmolNO2和YmolNO(X>Y)组成的混合气体,欲用m L含nmolNaOH的溶液吸收,使该混合气体全部转化成盐(NaNO3和NaNO2)进入溶液,则n的值至少是( )
| A.X/m mol | B.2X/3mol | C.(X+Y)mol | D.2(X+Y)/3mol |
某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
关于该固体混合物,下列说法正确的是
| A.一定含有Al,其质量为4.5g |
| B.一定不含FeCl2,可能含有MgCl2和AlCl3 |
| C.一定含有MgCl2和FeCl2 |
| D.一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产全部是NO)。向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列叙述中正确的是
| A.当生成沉淀达到最大值时,消耗NaOH溶液的体积一定为100mL |
| B.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol |
| C.当金属全部溶解时收集到NO气体的体积为2.24L |
| D.参加反应的金属的总质量一定是6.6g |
下列各表述与示意图不一致的是
A.图①表示向含Mg2+、Al3+、 的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+) :n(Al3+) :n( 的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+) :n(Al3+) :n( )=2 :1 :2,其中使用的NaOH的浓度为2 mol·L-1。 )=2 :1 :2,其中使用的NaOH的浓度为2 mol·L-1。 |
| B.图②中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)时,△H<0,若使用正催化剂,E值会减小。 |
| C.图③可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 |
| D.图④表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图 |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成甲、乙两份。向甲中逐渐加入铜粉,最多能溶解9.6g铜粉。向乙中逐渐加入铁粉,最多能溶解14.0g铁粉。 (假设硝酸只被还原为NO气体)。下列分析或结果错误的是
| A.原混合酸中NO3—物质的量为0.1 mol |
| B.乙中最多产生气体是0.2mol |
| C.原混合酸中HNO3浓度为1.0 mol·L-1 |
| D.原混合酸中H2SO4浓度为2.5 mol·L-1 |
现有三种制取硝酸铜的实验方案可供选用:下列有关说法正确的是
①铜与稀硝酸反应制取:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
②铜与浓硝酸反应制取:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:
2Cu+O2 2CuO,CuO+2HNO3==Cu(NO3)2+H2O
2CuO,CuO+2HNO3==Cu(NO3)2+H2O
| A.制取等量硝酸铜,需硝酸的量②最少 |
| B.制取等量的硝酸铜,②产生的有毒气体比①少 |
| C.三种方案中,第③方案最经济环保 |
| D.三种方案的反应都可以在铁质容器中进行 |
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6 mol·L—1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60 mL | B.50 mL | C.30 mL | D.15 mL |
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加人3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。则下列叙述中不正确的是( )
| A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL |
| B.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol |
| C.参加反应的金属的总质量为9.6 g>m>3.6 g |
| D.当金属全部溶解时收集到NO气体的体积一定为2.24 L。 |
试题篮
()