用右图所示装置进行下列实验,实验结果与预测的现象不一致的是

| |
①中的物质 |
②中的物质 |
预测①的现象 |
| A |
酚酞溶液 |
浓盐酸 |
无明显现象 |
| B |
淀粉KI溶液 |
浓硝酸 |
无明显现象 |
| C |
AlCl3溶液 |
浓氨水 |
有白色沉淀 |
| D |
湿润红纸条 |
饱和氯水 |
红纸条褪色 |
空气污染已成为人类社会面临的重大威胁。下列气体不属于大气污染物的是
| A.NO | B.CO2 | C.SO2 | D.NO2 |
m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中错误的是
| A.沉淀中OH-的质量为(n-m)g |
| B.恰好溶解后溶液中的NO3-的物质的量为aVmol |
C.反应过程中转移的电子的物质的量为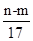 mol mol |
D.与合金反应的硝酸的物质的量为 mol mol |
下列有关实验操作、现象、解释和结论都正确的是( )
| |
操 作 |
现 象 |
解释、结论 |
| A |
把过量的Fe粉中加入硝酸中充分反应,滴入KSCN溶液 |
溶液呈红色 |
稀硝酸将Fe氧化为Fe3+ |
| B |
向饱和Na2CO3溶液中通入足量CO2 |
溶液变浑浊 |
析出了Na2CO3晶体 |
| C |
Al箔插入稀硝酸中 |
无现象 |
Al在硝酸中钝化,形成致密的氧化膜 |
| D |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上 |
试纸变蓝色 |
浓氨水呈碱性 |
关于下列各装置图的叙述中,不正确的是
| A.装置①中,d为阳极,c为阴极 |
| B.装置②可用于收集H2、NH3、CO2、Cl2、HC1、NO2等气体 |
| C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D.装置④可用于干燥、收集氨气,并吸收多余的氨气 |
NH3可消除NO的污染,反应方程式为:6NO+4NH3=5N2+6H2O。现有NO与NH3的混合物共1 mol充分反应,若还原产物比氧化产物多1.4g,则下列判断中正确的是( )
| A.原混合物中NO与NH3的物质的量之比可能为3:2 |
| B.有0.6 mol NH3被氧化 |
| C.生成还原产物2.8g |
| D.原混合气体中含氨气为0.2 mol或0.7 mol |
下列有关氮元素及其化合物的表示正确的是
A.质子数为7、中子数为8的氮原子: |
B.溴化铵的电子式: |
C.氮原子的结构示意图: |
D.间硝基甲苯的结构简式: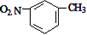 |
已知反应:2NO2+2NaOH=NaNO3+NaNO2+H2O ;NO+NO2+2NaOH=2NaNO2+H2O。现有XmolNO2和YmolNO(X>Y)组成的混合气体,欲用m L含nmolNaOH的溶液吸收,使该混合气体全部转化成盐(NaNO3和NaNO2)进入溶液,则n的值至少是( )
| A.X/m mol | B.2X/3mol | C.(X+Y)mol | D.2(X+Y)/3mol |
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )

| A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵 |
| B.图中C点对应溶液体积为48mL |
| C.原硝酸溶液中含硝酸的物质的量为0.5mol |
| D.样品中铝粉和铁粉的物质的量之比5:3 |
在防止禽流感疫情时,防疫部门使用了大量含氯类消毒剂,其中的一氯胺(NH2Cl)是一种长效缓释有机氯消毒剂,能水解生成具有强氧化性的物质,其杀菌能力是一般含氯消毒剂的4~5倍。下列有关一氯胺的说法正确的是( )
| A.一氯胺中氯元素的化合价为-1价 |
| B.一氯胺水解的产物为NH2OH(羟氨)和HCl |
| C.一氯胺起消毒作用的物质与漂白粉起消毒作用的物质相同 |
| D.一氯胺的摩尔质量为51.5 |
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是 ( )
| A.Cu与Cu2O 的物质的量之比为2:1 |
| B.硝酸的物质的量浓度为2.6mol/L |
| C.产生的NO在标准状况下的体积为4.48L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是( )
| A.大量排放NO和NO2等氮氧化物是形成光化学烟雾和酸雨的一个重要原因 |
| B.采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体 |
| C.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路” |
| D.大量燃烧化石燃料排放的废气中含大量SO2 ,从而使雨水的PH=5.6,形成酸雨 |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是( )

| A.混合酸中NO3-物质的量为0.4mol |
| B.OA段产生的是NO,AB段的反应为: Fe+2Fe3+→3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为5 mol·L-1 |
试题篮
()