(10分)垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。实验方案如下:
(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:__________________。
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是________(填序号)。
| A.铜粉 | B.氨水 | C.氢氧化铜 | D.碳酸铜 |
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=____________,此时________Cu(OH)2沉淀生成(填“有”或“无”)。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,反应的离子方程式为_______________。
(14分)某学生设计了一套验证物质化学性质的实验装置(如图):
请观察该装置图,完成下列问题:
(1)该实验的目的是 。
(2)该实验的涉及的化学方程式有 。
(3)实验用品:实验仪器除铁架台(带铁夹)、储气瓶(两个)、直管活塞(K1、K2)、止水夹(K3)、橡胶管、橡胶塞以及若干玻璃管连件外,还有哪几种(写仪器名称)_________________。
(4)实验步骤:①按上图连接好仪器装置;②扭开活塞K1和K2,主要现象为 ;③关闭 ,(填写K1或K2或K3)打开 ,(填写K1或K2或K3), 用手或热毛巾捂住圆底烧瓶,就能使烧瓶产生喷泉。
氨气具有广泛的用途。
(1)工业上合成氨反应的化学方程式是 。

(2)实验室常用如上图所示装置制取并收集氨气。
① 实验室制取氨气反应的化学方程式是 。
② 图中方框内收集氨气的装置可选用 (填字母序号)。
③ 尾气处理装置中使用倒扣漏斗的作用是 。
(3)工业上用NH3制取NO反应的化学方程式是 。
化学实验装置的科学设计是实验是否取得预期效果的关键。某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)碳与浓硝酸反应的方程式 。甲同学的实验应该在_____ 中进行,才符合化学实验安全性的要求。
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,所以他认为甲同学观点是错误的,他的理由是 (用化学方程式表示),所以他认为应该检验 (填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。
(3)请用平衡移动原理解释B装置的作用 (结合方程式与文字表述)。
(4)C装置中出现的现象是 ,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的离子方程式 。
(16分)甲、乙、丙三位同学在实验室用不同方法制取氮气。
(1)甲同学让空气通过下图所示装置,以除去氧气制得氮气。硬质玻璃管中所盛固体可选用 (填下列选项标号)

A.铁粉 B.碳粉 C.过氧化钠 D.碱石灰
(2)收集氮气可选用 (填下列选项标号)

(3)乙同学设计用氨气和炽热的氧化铜反应制取氮气,反应方程式为 。
(4)制取氨气可选用 (填下列选项标号)
A.加热硫酸铵与氢氧化钙混合物
B.加热分解氯化铵晶体
C.浓氨水滴入氢氧化钠固体
D.加热浓氨水使氨气化
(5)丙同学用加热两种含氮溶液制氮气
NaNO2+NH4Cl  NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
该实验装置需要 、分液漏斗、酒精灯等玻璃仪器。
(6)氮气助燃金属镁,反应方程式: ;燃烧3.6 g镁将消耗标准状况下氮气 mL.
资料显示:“氨气可在纯氧中安静燃烧……某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是 ;碱石灰的作用是 。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是 试管内气体变为红棕色,该反应的化学方程式是
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中。试管内气体颜色变浅,请结合化学方程式说明原因
(3)将过量的氧气与A产生的氨气分别从A、B两管进气口通人到装置C中,并在B管上端点燃氨气,两气体通入的先后顺序是:先通入______(O2 ,NH3 ),后通入__________(O2,NH3)其理由是
如图所示的实验装置可用来测定含两种元素的某种气体X的分子式。
在注射器A中装有240毫升气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32克,实验后B管重20.00克,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
(1)X气体是由________和________元素组成的。
(2)若240毫升X气体完全反应后,收集到的氮气质量是0.28克。根据实验时温度和压强计算1摩尔X气体的体积是24000毫升,则X的摩尔质量是________克/摩尔。
(3)通过计算,确定X的分子式为________。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)__________________。
某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空的注射器。
请回答有关问题:
(1)设计装置A的目的是 ;为达到此目的,应进行的操作是 。
(2)在完成(1)中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是 ;B中反应的离子方程式为: 。
(3)装置E和F的作用是 ;为实现此作用,其操作方法是 。
(4)装置D的作用是 。
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用图中装置可以实现该反应(夹持装置已省略)。
回答下列问题:
(1)A中加入的物质是 ,发生反应的化学方程式是 。
(2)B中加入的物质是 ,其作用是 。
(3)实验时在C中观察到得现象是 ,发生反应的化学方程式是 。
(4)实验时在D中观察到得现象是 ,D中收集到的物质是 ,检验该物质的方法和现象是 。
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。已知:氢氧化钠溶液不与NO反应,能与NO2反应。
2NO2+2NaOH====NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③④⑥中盛放的药品依次是:
、 、 。
(2)装置①中发生反应的化学方程式是 。
(3)装置②的作用是 ,发生反应的化学方程式是 。
(4)若①中消耗铜片12.8g,产生的氮氧化物与O2完全反应转化为硝酸,试计算消耗标准状况下O2的体积为 L。
(5)该小组得出的结论所依据的实验现象是 。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母) 。
| A.加热该绿色溶液,观察颜色变化 |
| B.加水稀释该绿色溶液,观察绿色变化 |
| C.向该绿色溶液中通入氮气,观察颜色变化 |
| D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化 |
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图所示。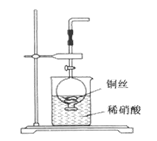
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
| A.铁 | B.铝 | C.铂 | D.玻璃 |
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是________(用化学方程式表示)。
(3)以下收集NO气体的装置,合理的是________(填选项代号)。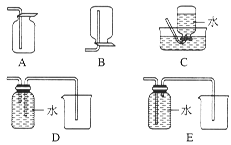
(4)假设实验中12.8 g Cu全部溶解,需要通入标况下________L O2才能使NO全部溶于水。
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”)。
甲:铜 硝酸铜
硝酸铜
乙:铜 硝酸铜
硝酸铜
丙:铜 氯化铜
氯化铜 硝酸铜
硝酸铜
丁:铜 氧化铜
氧化铜 硝酸铜。
硝酸铜。
(15分)颗粒大小达到纳米级的单质铁俗称“纳米铁”,可用作手机辐射屏蔽材料。实验室的制备方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2反应生成“纳米铁”,实验装置如下图。请回答:
(1)A装置用于制取氮气,反应的化学方程式为_________。
(2)实验时,应先将____(填“N2”或“H2”)通入C装置,反应生成“纳米铁”的化学方程式为 ;实验中需要保护气的原因是_________。
(3)a导管口的气态产物除HC1外还可能有_________(填化学式)。
(4)利用D装置也可以得到较纯净的氮气。但科学家发现,采用此方法在b导管口得到的氮气在相同条件下比原方法得到的氮气密度略大,原因是_________(假设上述实验设计与操作均无错误,且氮气已完全干燥);若开始加入的铜粉质量为3.84 g,持续通人空气至铜粉全部反应,冷却后固体质量为4.48 g,则固体的成分为_________,反应的化学方程式为_____.
资料显示:“氨气可在纯氧中安静燃烧”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是_____ ___________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是 ;试管内气体变为红棕色,该气体是__________________。
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因 。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是 。
②氨气燃烧的化学方程式是 。
“摩尔盐”[ (NH4)2Fe(SO4)2·6H2O ] 是分析化学中的重要试剂。查阅文献得知:“摩尔盐”隔绝空气加热至500℃时可完全分解,但产物复杂。某学习小组欲探究其分解产物。
Ⅰ.【提出猜想】摩尔盐受热分解,小组同学认为分解产物可能有以下几种情况:
a.Fe2O3、SO3、NH3、H2O b.FeO、NH3、SO3、H2O
c.FeO、SO2、NH3、H2O d.Fe2O3、NH3、SO2、SO3、H2O
经认真分析,通过推理即可确定,猜想 不成立(填序号)。
Ⅱ.【实验探究】为检验分解产物,甲同学设计了如下实验装置。
请回答下列问题:
(1)B装置的容器名称是 。
(2)取一定量“摩尔盐”置于加热管A中,加热至分解完后打开K,再通入N2,目的是 。
(3)观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为_________________________。
(4)待A中剩余固体冷却至室温后,取少量置于试管中,加入稀硫酸溶解,再滴几滴KSCN溶液,可以观察到的现象是 。
(5)乙同学设计实验验证A中残留物不含FeO,操作方法及实验现象是:取少量A中残留物放入试管中, 。
Ⅲ.【实验反思】
乙同学认为:装置B中产生白色沉淀不能证明分解产物中一定含SO3,原因是 。
地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题,某课题组利用Fe粉和酸性KNO3溶液反应模拟地下水脱氮过程,理想的脱氮原理为:4Fe + NO3- + 10H+ = 4Fe2+ + NH4+ + 3H2O。
(1)研究发现:随着KNO3溶液酸性的减弱,对应还原产物中氮元素的化合价越低。课题组用酸性弱的KNO3溶液进行实验,没有观察到气体生成,则该条件下KNO3的还原产物可能是 (化学式)。
(2)实验发现:反应一段时间后,反应体系中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是 。
a.生成的Fe2+水解 b.Fe2+被氧化生成Fe3+ c.Fe2+被还原成Fe
(3)该课题组拟利用上述脱氮反应研究不同自变量对反应速率的影响。
可能用到的试剂和仪器:粗颗粒Fe粉、细颗粒Fe粉、2.0mol/L KNO3、0.1 mol/L H2SO4、蒸馏水、不同温度的恒温水浴、托盘天平、秒表、离子色谱仪等。
①设计实验方案:在不同的自变量(温度、铁粉颗粒的大小)时,测定 (要求所测得的数据能直接体现反应速率大小)。
②参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据:数据用字母表示)。
【提示】离子色谱仪能跟踪测定溶液中的c(NO3-)
| 物理量 实验序号 |
V(2.0mol/L KNO3)/ mL |
|
…… |
| 1 |
a |
|
…… |
| 2 |
a |
|
…… |
| 3 |
a |
|
…… |
③进一步的研究表明:将铁粉和活性炭同时加入上述KNO3溶液中,可以明显提高脱氮速率,其原因是 。
试题篮
()