铵明矾【NH4Al(SO4)2·12H2O】是常见的食品添加剂,用于焙烤食品,可通过硫酸铝溶液和硫酸铵溶液反应制备。用芒硝(Na2SO4·10H2O)制备纯碱和铵明矾的生产工艺流程图如图1:

完成下列填空:
31.铵明矾溶液呈 性,它可用于净水,原因是 ;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是 。
32.写出过程Ⅰ的化学反应方程式 。
33.若省略过程Ⅱ,直接将硫酸铝溶液加入滤液A中,铵明矾的产率会明显降低,原因是 。
34.已知铵明矾的溶解度随温度升高明显增大。加入硫酸铝后,经过程III的系列实验得到铵明矾,该系列的操作是加热浓缩、 、过滤洗涤、干燥。
35.某同学用图2图示的装置探究铵明矾高温分解后气体的组成成份。
(1)夹住止水夹K1,打开止水夹K2,用酒精喷灯充分灼烧。实验过程中,装置A和导管中未见红棕色气体;试管C中的品红溶液褪色;在支口处可检验到NH3,方法是 ;在装置A与B之间的T型导管中出现白色固体,该白色固体可能是 (任填一种物质的化学式);另分析得出装置A试管中残留的白色固体是两性氧化物,写出它溶于NaOH溶液的离子方程式 。
(2)该同学通过实验证明铵明矾高温分解后气体的组成成份是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)= 。
某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
关于该固体混合物,下列说法正确的是
| A.一定含有Al,其质量为4.5g |
| B.一定不含FeCl2,可能含有MgCl2和AlCl3 |
| C.一定含有MgCl2和FeCl2 |
| D.一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料]在260
和400
时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)

实验1:连接装置,检查气密性,按图示加入试剂(装置
盛0.5000
盐酸70.00
)。通入
排尽空气后,于260
加热装置
一段时间,停止加热,冷却,停止通入
。品红溶液不褪色,取下装置
,加入指示剂,用0.2000
溶液滴定剩余盐酸,终点时消耗
溶液25.00
。经检验滴定后的溶液中无
。
(1)仪器的名称是。
(2)滴定前,下列操作的正确顺序是(填字母编号)。
a.盛装0.2000溶液
b.用0.2000溶液润洗
c.读数、记录
d.查漏、清洗
e.排尽滴定管尖嘴的气泡并调整液面
(3)装置内溶液吸收气体的物质的量是
实验2:连接装置
,检查气密性,按图示重新加入试剂。通入
排尽空气后,于400
加热装置
至
完全分解无残留物,停止加热,冷却,停止通入
。观察到装置
、
之间的导气管内有少量白色固体。经检验,该白色固体和装置
内溶液中有
,无
。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置内溶液中有
,无
的实验操作和现象是.
(5)装置内溶液吸收的气体是.
(6)在400
分解的化学方程式是.
氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。
完成下列计算:
1.质量分数为0.90的石灰石100
完成分解产生
(标准状况)。石灰窑中,该29120
(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生
,则焦炭的物质的量为mol。
2.已知粗盐水含 6.80
,含
3.00
。
向粗盐水中加入除镁离子:
然后加入除钙离子。
处理上述粗盐水10,至少需要加
g。
如果用碳酸化尾气(含体积分数为0.100、
体积分数0.040)代替碳酸钠,发生如下反应:
处理上述10 粗盐水至少需要通入多少
(标准状况)碳酸化尾气?列式计算。
3.某氨盐水含氯化钠1521 ,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070
。列式计算:
(1)过滤后溶液中氯化钠的质量。
(2)析出的碳酸氢钠晶体的质量。
及其盐都是重要的化工原料。
(1)用和
制备
,反应发生、气体收集和尾气处理装置依次为。
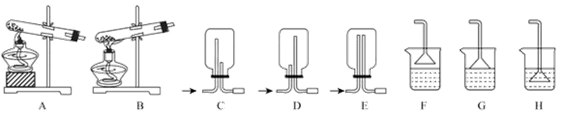
(2)按下图装置进行性质实验。
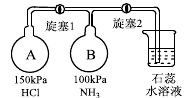
①先打开旋塞1,瓶中的现象是,原因是,稳定后,关闭旋塞1。
②再打开旋塞2,瓶中的现象是。
(3)设计实验,探究某一种因素对溶液中水解程度的影响。
限制试剂与仪器:固体、蒸馏水、100
容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、
计、温度计、恒温水浴槽(可控制温度)
①实验目的:探究对溶液中水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中(溶液)表示所配制溶液的体积)。
| 物理量 实验序号 |
…… |
||||
| 1 |
100 |
||||
| 2 |
100 |
③按实验序号I所拟数据进行实验,若读取的待测物理量的数值为,则
水解反应得平衡转化率为(只列出算式,忽略水自身电离的影响)。
某研究小组将纯净的气体通入0.1
的
溶液中,得到了
沉淀,为探究上述溶液中何种微粒能氧化通入的
,该小组突出了如下假设:
假设一:溶液中的
假设二:溶液中溶解的
(1)验证假设一
该小组涉及实验验证了假设一,请在下表空白处填写相关实验现象
| 实验步骤 |
实验现象 |
结论 |
| 实验1:在盛有不含 |
假设一成立 |
|
| 实验2:在盛有不含 |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的随通入
积的变化曲线入下图

实验1中溶液变小的原因是;
时,实验2中溶液
小于实验1的原因是(用离子方程式表示)。
(3)验证假设二
请设计实验验证假设二,写出实验步骤,预期现象和结论。
| 实验步骤、预期现象和结论(不要求写具体操作过程) |
(4)若假设二成立,请预测:在相同条件下,分别通入足量的和
,氧化相同的
溶液(溶液体积变化忽略不计),充分反映后两溶液的
前者(填大于或小于)后者,理由是
已知:Fe2+能被稀硝酸氧化,反应方程式为:3Fe(NO3)2+4HNO3(稀) 3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表:
3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表:
| 硝酸体积(mL) |
100 |
200 |
300 |
400 |
| 剩余固体(g) |
18.0 |
9.6 |
0 |
0 |
| 放出气体的体积(mL) |
2240 |
4480 |
6720 |
|
(1)由NO与HNO3的关系可知,稀硝酸的物质的量浓度为_______ mol·L-1。
(2)稀硝酸的密度为__________g/cm3。
(3)放出2240 mL气体时,反应的离子方程式是_____________________________,放出4480 mL气体时,消耗金属的质量为_______g。
(4)原混合物中铁和铜的物质的量比为__________。
(5)加入400 mL稀硝酸,反应完全后,溶液中NO3-的物质的量为________mol。
(6)当溶液中Cu2+、Fe2+的物质的量浓度相等时,放出气体的体积_________mL(标准状况下)。
磷酸分子间脱水会形成多种聚磷酸,它们的钠盐是广泛使用的食品添加剂。将48gNaOH与58.8g固态纯H3PO4在一定温度下加热,得到79.8g固体A和27g水,则A可能是
| A.Na3PO4 | B.Na4P2O7 |
| C.Na4P2O7和Na5P3O10 | D.Na3PO4、Na4P2O7和Na5P3O10 |
氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式:____________
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是_____
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是_____
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.050 |
n2 |
0.080 |
0.080 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为____________
②n3 n4(填“>”、“<”或“=”),该反应的平衡常数K的值为 ,升高温度后,反应2NO2 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
| A.原混合酸中NO3-物质的量为0.4 mol |
| B.原混合酸中H2SO4浓度为2.0 mol·L-1 |
| C.第二份溶液中最终溶质为FeSO4 |
D.OA段产生的是 NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
某研究性学习小组选用以下装置进行实验设计和探究(图中a、b、c均为止水夹)
(1)在进行气体制备时,应先检验装置的气密性。将A装置末端导管密封后,在A装置的分液斗内装一定量的蒸馏水,然后 ,则证明A装置的气密性良好。
(2)用锌粒和稀硫酸制备H2时应选用装置____作为发生装置(填所选装置的序号字母),实验时可先在稀硫酸溶液中加入少量硫酸铜晶体会使反应速率加快,原因是 。
(3)某同学利用上述装置设计实验证明Cl2氧化性强于Br2
①选用的装置连接顺序为:( )→( )→( )(填所选装置的序号字母);
②从以下试剂中选用该实验所需的试剂为 (填试剂的序号字母);
a.浓硫酸
b.浓盐酸
c.二氧化锰
d.氯化钠
e.溴化钠溶液
③实验过程中能说明Cl2氧化性强于Br2的实验现象是 ;
(4)另一同学将B、D、E装置连接后,在B装置中加入铜片和浓硝酸制取NO2,然后进行NO2气体与水反应的实验,并观察相关现象:
①B装置发生反应的离子方程式为____;
②反应一段时间后D装置中的具支试管乙中收集满NO2气体,若进行NO2气体与水反应的实验,应 (填“对a、b、c三个止水夹进行的操作”),然后再适当加热乙;实验现象为 。
③E装置中的NaOH溶液可吸收尾气NO2,反应生成NaNO3、NaNO2和H2O,反应中生成的NaNO3和NaNO2的物质的量之比为 。
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)As2S3和HNO3有如下反应,As2S3+10H++ 10NO3—="2H3AsO4+" 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(3)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5mol c.大于0.5mol d.无法确定
在1L浓度为0.2mol•L﹣1Fe(NO3)3和1.5mol•L﹣1H2SO4组成的混合溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是( )
| A.由于氧化性Fe3+>H+,故反应先不产生气体后产生气体 |
| B.反应后产生13.44LH2(标准状况) |
| C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol |
| D.反应后溶液中Fe3+物质的量为0.8mol |
氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3¯,两步反应的能量变化示意图如下:

下列说法合理的是:
| A.该反应的催化剂是NO2¯ |
| B.升高温度,两步反应速率均加快,有利于NH4+转化成NO3¯ |
| C.在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态 |
| D.1 mol NH4+在第一步反应中与1 mol NO2-在第二步反应中失电子数之比为1:3 |
(一) 尿素又称碳酰胺,是含氮量最高的氮肥,工业上利用二氧化碳和氨气在一定条件下合成尿素。其反应分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵)(l) △H1= -330.0 kJ·mol-1
H2NCOONH4(氨基甲酸铵)(l) △H1= -330.0 kJ·mol-1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2=" +" 226.3 kJ·mol-1
H2O(l)+H2NCONH2(l) △H2=" +" 226.3 kJ·mol-1
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 m3 密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min)。
③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,则CO(NH2)2(l)的质量_________(填“增加”、“减小”或“不变”)。
(二)氨是制备尿素的原料,NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
氨气溶于水得到氨水,在25℃下,将amol/L的氨水与bmol/L的硫酸以3∶2体积比混合反应后溶液呈中性。用含a和b的代数式表示出氨水的电离平衡常数为_________。
(三)氢气是合成氨的原料。“氢能”将是未来最理想的新能源。
(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g) CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
①当加热到850℃反应达到平衡的标志有______________ 。
| A.容器内的压强不变 |
| B.消耗水蒸气的物质的量与生成CO的物质的量相等 |
| C.混合气的密度不变 |
| D.单位时间有n个H-O键断裂的同时有n个H-H键断裂 |
②x应满足的条件是 。
(四)CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2。华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示: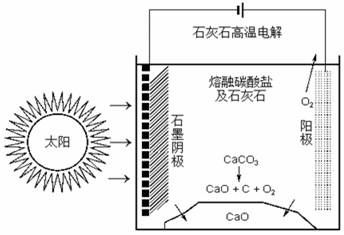
(1)上述生产过程的能量转化方式是 。
(2)上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为 ,阴极的电极反应式为 。
试题篮
()