下列有关物质的性质与应用不相对应的是
| A.明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| B.FeCl3溶液能与Cu 反应,可用于蚀刻印刷电路 |
| C.SO2具有氧化性,可用于漂白纸浆 |
| D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
下列由相关实验现象所推出的结论正确的是
| A.向氯水中加入有色布条,片刻后有色布条褪色,说明有Cl2存在 |
| B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42 |
| C.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 |
| D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
下列说法不正确的是
| A.铜片在稀硫酸和NaNO3混合溶液中可溶解 |
| B.常温常压下,46gNO2和N2O4混合气体共含有3mol原子 |
| C.光纤通讯中制造光纤的基本原料是SiO2 |
| D.光照氯水有气泡逸出该气体是Cl2 |
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq) AlCl3
AlCl3 Al
Al
②NH3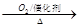 NO
NO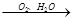 HNO3
HNO3
③NaCl(饱和溶液)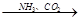 NaHCO3
NaHCO3 Na2CO3
Na2CO3
④FeS2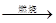 SO3
SO3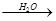 H2SO4
H2SO4
| A.②③ | B.①④ | C.②④ | D.③④ |
下列现象或事实不能用同一原理解释的是
| A.浓硝酸和氯水用棕色细口试剂瓶保存 |
| B.硫化钠和亚硫酸钠固体长期暴露在空气中变质 |
| C.Cl2和SO2都能使品红溶液褪色 |
| D.SO2和FeSO4溶液都能使KMnO4溶液褪色 |
下列叙述不正确的是
| A.将SO2通入BaCl2溶液中至饱和,无沉淀产生;再通入Cl2产生沉淀 |
| B.向AlCl3溶液中加氨水,产生白色沉淀;再加入过量氨水,沉淀消失 |
| C.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解 |
| D.纯锌与稀硫酸反应产生氢气的速率较慢:再加入少量CuSO4固体,速率加快 |
如图示的装置中,把X溶液逐滴滴下与Y物质反应,若X为浓硫酸,Y为第三周期金属元素中常温下与水难反应的单质。Z为品红溶液。实验中观察到Z褪色。则Y为
| A.Na | B.Mg | C.Al | D.Mg或Al |
下列各组物质的溶液混合后,再加足量的稀硝酸,仍有沉淀存在的是
| A.K2CO3、BaCl2 | B.NaOH、CuSO4 |
| C.AgNO3、NaCl | D.Na2CO3、CaCl2 |
下列推断正确的是
| A.SO2和CO2都是酸性氧化物,都能与NaOH溶液反应 |
| B.Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同 |
| C.NO和NO2的密度都比空气大,都可以用向上排空气法收集 |
| D.C3H8和CH3CH2OH相对分子质量相近,二者沸点也相近 |
下列叙述中正确的是
| A.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| B.能使润湿的淀粉KI试纸变成蓝色的物质一定是C12 |
| C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| D.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
根据下图海水综合利用的工业流程图,判断下列说法正确的是
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
| A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 |
| B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.从能量角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
| D.从第③步到第⑤步的目的是为了浓缩富集溴 |
试题篮
()