某学生设计了如图的方法对A盐进行鉴定:
由此分析,下列结论中,正确的是
| A.A中一定有Fe3+ | B.B为AgI沉淀 |
| C.C中一定有Fe3+ | D.A一定为FeBr2溶液 |
多硫化钠Na2Sx( )在结构上与Na2O2, FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的量之比为1:16,则x值是
)在结构上与Na2O2, FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的量之比为1:16,则x值是
| A.5 | B.4 | C.3 | D.2 |
相同温度下,下列实验过程中,溶液的浓度和质量始终不变的是
| A.向98.3%浓H2SO4中通入n g SO3 |
| B.向浓氨水中持续通入干燥洁净的空气(已除去(CO2)) |
| C.向KNO3饱和溶液中加入n gKNO3晶体 |
| D.向CuSO4饱和溶液中加入n g无水CuSO4 |
0.1mol某固体M(NO3)2加热分解:2M(NO3)2 =" 2MO " + 4NO2↑ + O2↑,将产生的气体用排水法收集,在标准状况下收集到的气体的体积接近
| A.5.6L | B.4.48L | C.0L | D.1.12L |
下列说法中正确的是
| A.久置的浓HNO3呈黄色,为除去黄色可通入O2 |
| B.NH4Cl4固体中混有I2,可用加热的方法除去 |
| C.为除去FeSO4溶液中的Fe2(SO4)3可加入Cu 粉 |
| D.为除去SO2中少量的CO2,可使其通过澄清石灰水 |
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4 = ZnS↓+BaSO4↓。以下是工业生产流程。请回答有关问题:
Ⅰ.ZnSO4溶液的制备与提纯
有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等。 (1)②中使用的氧化剂最好是下列的 (填序号),理由是 。
(1)②中使用的氧化剂最好是下列的 (填序号),理由是 。
| A.Cl2 | B.H2O2 | C.KMnO4 | D.浓HNO3 |
(2)写出反应④的离子方程式: 。
(3)为了达到综合利用、节能减排的目的,上述流程中步骤 产生的 可以用于步
骤 (其中步骤选填①、②、③、④、⑤)。
Ⅱ.BaS溶液的制备 有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = —1473.2 kJ•mol-1
有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = —1473.2 kJ•mol-1
C(s)+ —O2(g)=CO(g); △H = —110.5 kJ•mol-1
Ba(s)+ S(s)=BaS(s); △H = —460 kJ•mol-1
(4)煅烧还原的热化学方程式为: 。
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
| 物质 选项 |
a |
b |
c |
| A |
Al2O3 |
AlCl3 |
Al(OH)3 |
| B |
CuO |
Cu(OH)2 |
CuCl2 |
| C |
SiO2 |
Na2SiO3 |
H2SiO3 |
| D |
CO |
NaHCO3 |
Na2CO3 |

德国科学家格哈德·埃特尔研究的内容能够帮助我们理解铁会生锈、燃料电池如何工作、催化剂如何工作而获得2007年诺贝尔化学奖。下列相关说法正确的是 ( )
| A.含碳生铁在发生电化学腐蚀的时候铁一般做正极 |
| B.C2H6、O2、KOH构成的燃料电池放电一段时间后,负极周围的pH升高 |
| C.CO、O2、KOH构成的燃料电池的负极反应:CO—2e-+4OH-=CO2-3+2H2O |
| D.SO2被氧化为SO3时需使用V2O5催化剂,这样可以提高SO2的转化率 |
在给定条件下,下列加点的物质在化学反应中能完全消耗的是 ( )
| A.在5×107Pa、500℃和铁触媒催化的条件下,用1mol氮气和4mol氢气合成氨 |
| B.标准状况下,将1g铁片投入15mL18.4 mol·L-1的硫酸中 |
| C.向150mL3 mol·L-1的硝酸中加入6.4g铜 |
| D.用50mL8 mol·L-1浓盐酸与10g二氧化锰共热制取氯气 |
实验室里不宜长期放置,应在使用时才配制的试剂是 ( )
①酚酞试液 ②银氨溶液 ③Na2CO3溶液 ④Cu(OH)2悬浊液
⑤酸性FeCl3溶液 ⑥FeSO4溶液 ⑦NaCl溶液 ⑧氯水
| A.②⑤⑥⑧ | B.①③④⑤ | C.①②⑤⑦ | D.②④⑥⑧ |
己知Zn跟一定量的浓H2SO4反应生成的气体产物有2种;请从下图中选用所需的仪器组成一套进行该反应并检出气体产物的装置(装置可重复选用,假设每步反应都进行的完全,且无需干燥)。现提供Zn、浓H2SO4、其它试剂自选(固定仪器用的铁夹、铁架台及加热装置等均略去)。将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加的试剂、作用及现象。(可不填满, 也可加行)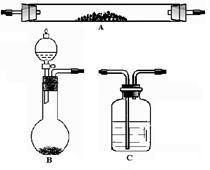
| 选用的仪器 (填字母) |
加入的试剂 |
作用 |
现象 |
| |
Zn、 浓H2SO4、 |
产生2种气体 |
/ |
| |
|
|
|
| |
|
除SO2 |
/ |
| |
|
|
|
| |
|
|
|
近年,我国在航天事业上取得了令世界瞩目的成就,神舟飞船多次被长征系
列火箭送入太空。
(1)长征二号捆绑式火箭推进剂以联氨(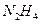 )作为燃料,
)作为燃料,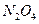 作为推进剂。
作为推进剂。
①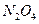 的主要作用是助燃,但其在工作时会产生红棕色气体
的主要作用是助燃,但其在工作时会产生红棕色气体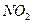 ,对环境会造
,对环境会造
成污染,为避免污染可使用下列 (填字母)代替之。
| A.液态氨 | B.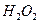 |
C.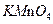 |
D.液态氧 |
②在碱性条件下,用尿素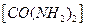 和次氯酸钠反应可以制取联氨(产物中
和次氯酸钠反应可以制取联氨(产物中
同时有两种正盐),则该反应的离子方程式是 。
(2)飞船座舱内空气的更新过程如下图所示: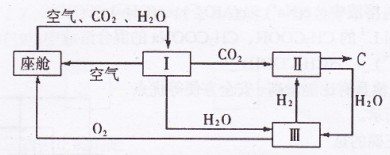
①座舱内空气更新过程可以循环利用的物质为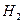 、
、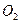 和 ;装置Ⅱ中
和 ;装置Ⅱ中
发生反应的化学方程式为 。
②从装置I、Ⅱ、Ⅲ可看出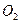 的来源,若宇航员每天消耗35mol
的来源,若宇航员每天消耗35mol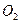 ,每天呼出
,每天呼出
的气体中含18 mol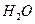 ,则呼出的气体中含
,则呼出的气体中含 mol.
mol.
 、
、 、
、 、
、 均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其它
均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其它
产物已略去):
下列说法不正确的是
A.若 是单质铁,则 是单质铁,则 溶液可能是FeCl2溶液 溶液可能是FeCl2溶液 |
B.若 是氢氧化钠,则 是氢氧化钠,则 与 与 可反应生成 可反应生成 |
C.若 是金属镁,则 是金属镁,则 可能是强氧化性的单质 可能是强氧化性的单质 |
D.若 为甲醇,则 为甲醇,则 、 、 的相对分子质量可能相差14 的相对分子质量可能相差14 |
不定项选择题:本题包括6小题,每小题4分,共计24分。每小题有一个或两个选项符
合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,
只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
下列各组反应能产生可燃性气体的是 ( )
| A.铜投入到浓硝酸中 | B.碳投入到热的浓硫酸中 |
| C.电石投入到水中 | D.碳酸钙投入到盐酸中 |
试题篮
()