用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(1)图中A仪器的名称为: ,
D装置在实验中的作用是 。
(2)若A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中的现象为 ,
C中发生反应的化学方程式为: 。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是 ;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被氧化为HIO3,写出该反应的化学方程式 。
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是 ,C中发生反应的离子方程式为: 。
(12分)化合物X由元素A、B组成,可用于制造高性能的现代通讯材料—光导纤维;化合物Y由不同短周期元素C、D组成,是良好的耐热、耐冲击材料。
(1)已知A的一种单质是一种重要的半导体材料,则A在元素周期表中的位置是 。A可由X与焦炭在高温下反应制得,其反应的化学方程式为 。
(2)X与纯碱高温熔融时能生成Z,同时还生成一种气体M;将一定量气体M通入z的水溶液中生成白色沉淀和纯碱溶液。X与纯碱高温熔融能发生反应的原因是 ;M与Z的水溶液能发生反应的原因是 。要将纯碱高温熔化,下列坩埚中不可选用的是 。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(3)C的单质既可与盐酸、又可与NaOH溶液反应。一定条件下,Y和水作用生成含D的化合物W,W是一种含有10个电子的碱性气体。则Y的化学式是 。
(4)C的单质、石墨和二氧化钛(TiO2)按一定比例在高温下反应得到两种化合物,两种化合物均是由两种元素组成的新型陶瓷材料,则反应的化学方程式是 。
喷泉是一种常见的现象,其产生原因是存在压强差。
(1)图Ⅰ为化学教学中常用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中能形成喷泉的是
A. SO2和H2O B. CO2和NaOH溶液
C. Cl2和H2O D. NO和H2O
(2)在图Ⅱ的锥形瓶中,分别加入足量的下列物质后,能产生喷泉的是
A. Cu与稀硫酸 B. Cu与稀硝酸 C. Al与浓硝酸 D. Fe与浓硝酸
(3)比较图Ⅰ和图Ⅱ两套装置,从产生喷泉的原理来分析,图Ⅰ是 上部烧瓶内气体压强;图Ⅱ是 下部锥形瓶内气体压强(均填“增大”或“减小”)。
(4)某学生积极思考喷泉原理的应用,设计了如图Ⅲ所示的装置。
① 如果关闭活塞c,打开活塞a、b,再挤压胶头滴管。则可能出现的现象为 。
②在①操作的基础上,若要在该装置中产生双喷泉现象,其操作方法是 。
将与“实验操作”相对应的“实验现象”的字母代号填入“答案”栏中。
| 实验操作 |
答案 |
实验现象 |
| (1)将浓硫酸滴在小木条上 |
|
A.产生白烟 |
| (2)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近 |
|
B.产生蓝色物质 |
| (3)在盛有KI淀粉溶液的试管中滴加氯水 |
|
C.溶液呈红色 |
| (4)在盛有FeC13溶液的试管中滴入2滴KSCN溶液 |
|
D.变黑色 |
我们知道“喷泉”是一种常见的自然现象,其产生的原因是存在压强差。
(1)图甲为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管与烧杯中分别盛有液体。挤压滴管的胶头,下列与实验事实不相符的是()
A.CO2(NaHCO3溶液)/无色喷泉
B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉
D.HCl(AgNO3溶液)/白色喷泉
(2)某学生积极思考产生喷泉的其他方法,并设计了图乙所示装置。
①在图乙的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
这种方法产生喷泉的原理是
②在图乙锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冰水后,再加入足量的下列物质,结果也产生喷泉。水槽中加入的物质可以是
A.浓硫酸 B.食盐 C.硝酸钾 D.硫酸铜
③比较上述图甲和图乙两套装置,从产生喷泉原理来分析,图甲是 上部烧瓶内压强;图乙是 下部锥形瓶内气体压强(均填“增大”或“减小”)。
(3)城市中常见的人造喷泉及火山爆发的原理与上述 (填“图甲”或“图乙”)装置的原理相似。
(14分)X、Y、Z、W、G、和H均由短周期元素组成,它们是中学化学中常见的气体,具有如下性质:
①X、Y、G能使湿润的蓝色石蕊试纸变红,H能使湿润的红色石蕊试纸变蓝,Z、W不能使湿润的石蕊试纸变色;
②X和H相遇产生白烟;
③Y是形成酸雨的主要气体且能使品红溶液褪色;
④Z和W相遇生成红棕色气体;
⑤G在W中燃烧可以产生Y和H2O;
⑥回答下列问题:
(1) H的化学式是__________,
实验室制取H的化学反应方程式是___________________________________________;
(2)Z的化学式是________,W的化学式是__________________;
(3)⑤中发生反应的化学方程式是___________________________________________;
(4)实验室制备、收集干燥的Y气体,所需仪器如下。装置A产生Y气体,按气流方向连接各仪器接口,顺序为a



 f:
f:
装置D的作用是_ ___,装置E中NaOH溶液的作用是__ ____。
有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO、Cl-、NO等离子中的若干种。现做如下实验:
(1)取少量该溶液,滴入用硝酸酸化的AgNO 3溶液,有白色沉淀生成。
(2)另取部分溶液,加入氢氧化钠,有白色沉淀产生,加入氢氧化钠的量与生成白色沉淀的量可用下图表示。
试推断:
(1)该溶液中一定存在__________ ____,一定不存在________________。
(2)上述溶液中至少有__________、_________(填化学式)等物质混合而成;其物质的量比为 。
(3) 写出图中a b变化过程的离子方程式 。
b变化过程的离子方程式 。
(12分)根据下表左边的“实验操作”,从右边的“实验现象”中选择正确的字母代号,填入对应“答案”的空格中。
| 实验操作 |
答案 |
实验现象 |
| (1)让一束光线通过Fe(OH)3胶体 |
|
A.呈蓝色 B.生成白色胶状沉淀 C.呈现光亮“通路” D.产生红褐色沉淀 |
| (2)向盛有FeCl3溶液的试管中加入NaOH溶液 |
|
|
| (3)向Al2(SO4)3溶液中滴加氨水 |
|
|
| (4)向土豆片上滴加碘水 |
|
氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;_________(请按正确的顺序填入下列步骤的标号)。
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此判断,上述实验确有CaH2生成。
① 写出CaH2与水反应的化学方程式 ___________________;
②该同学的判断不正确,原因是_________________;
(4)请设计实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象______。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________。
(14分)某同学设计如图装置,研究非金属元素性质变化规律。
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色。在化学反应中,一般地,强酸能制弱酸,现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2Si O3。
O3。
A中装试剂________,B中装试剂________,C中装试剂________。C中实验现象为__________;写出C中发生反应的离子方程式______________________________________。
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用如图装置证明氯气氧化性强于碘单质的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末,C中装试剂________,C中现象______________________。写出离子方程式________________________________。该实验该装置有明显不足,请指出改进方法:_____________________________________________。
(3)如果C中装饱和的氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,写出化学方程式________________________________;
证明氯的非金属性比硫的非金属性________(填“强”“弱”或“无法判断”)。
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A—E为实验室 常见的仪器装置(部分固定夹持装置略去),请根据要求
常见的仪器装置(部分固定夹持装置略去),请根据要求 回答问题。
回答问题。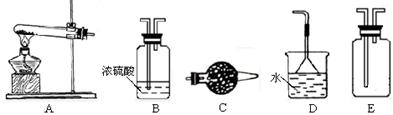
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置中的 ▲ 。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是
▲ ,写出制纳米级碳酸钙的化学方程式: ▲ 。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级。
▲ 。
如图所示,将甲、乙两 个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定,溶液浓度相同)。
个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定,溶液浓度相同)。
试回答下列问题:
| 实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
| 1 |
10mLFeSO4溶液 |
10mLNH3 |
生成白色沉淀,后变色 |
| 2 |
10mLAlCl3溶液 |
40mLNaOH溶液 |
|
| 3 |
10mL紫色石蕊试液 |
25mLCl2 |
|
| 4 |
15molCl2 |
40mLNH3 |
|
⑴实验1中,沉淀最终变为 色,写出沉淀变色的化学方程式 。
⑵实验2甲针筒内的现象是: ,写出有关反应的离子方程式: 、 。
⑶实验3甲针筒内的现象是: ,反应后乙针筒内有少量的残留气体,正确的处理方法是将其通入 溶液中 。
。
⑷实验4中,已知:3Cl2+2NH3=N2+6HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为 。
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是(用离子反应方程式表示) 。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是 。
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。
①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是 。
②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生。充分反应后集气瓶中气体能使带余烬的木条复燃。写出在光照下混合液中反应的化学方程式是
。
(4)若将V1 mL 0.1mol/L KAl(SO4)2溶液和V2mL 0.1mol/LBa(OH)2溶液混合。当产生沉淀物质的量最多时,V1:V2 = 。
(15分)下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
Ⅰ.硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的括号内:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
(1)浓硫酸可以干燥氢气
(2)浓硫酸使木条变黑
(3)热的浓硫酸与铜片反应
Ⅱ.现用该浓硫酸配制100 mL 1 mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有
(写仪器名称);
(2)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用 (选填①10mL、②50mL 、③100mL)规格的量筒;
试题篮
()