向18.4g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3g沉淀.另取等质量的合金,使其与一定量的氯气恰好完全反应,则氯气的体积在标准状况下为( )
| A.7.84L | B.6.72L | C.4.48L | D.无法计算 |
下列叙述正确的是( )
| A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 |
| B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 |
| C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 |
| D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变 |
一定条件下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| A.① | B.② | C.③ | D.④ |
下列有关物质的性质和应用对应正确的是( )
| A.炭在常温下化学性质不活泼,因此在埋木桩前,可将埋入地下的一段表面用火微微烧焦 |
| B.碳酸钠的水溶液呈碱性,医学上能用于治疗胃酸过多 |
| C.盐酸与苛性钠可自发进行反应,该反应可以设计成原电池 |
| D.次氯酸具有强氧化性,可以起到除去水中悬浮的杂质和杀菌消毒作用 |
下列说法正确的是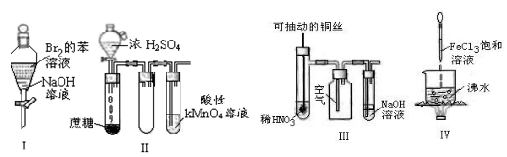
| A.实验I:充分振荡后静置,上层溶液颜色保持不变 |
| B.实验Ⅱ:酸性KMnO4溶液中出现气泡,但溶液颜色不变 |
| C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D.实验Ⅳ:煮沸至溶液呈红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
下列有关物质的性质和该性质的应用均正确的是
| A.SO2具有氧化性,可用于漂白纸浆 |
| B.碳具有还原性,一定条件下能将二氧化硅还原为硅 |
| C.BaCO3、BaSO4都难溶于水,均可用做钡餐 |
| D.Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 |
下图装置用于气体的干燥、收集和尾气吸收,其中X、Y、Z对应都正确的是

| |
X |
Y |
Z |
| A |
无水硫酸铜 |
氯气 |
饱和食盐水 |
| B |
碱石灰 |
氨气 |
水 |
| C |
氯化钙 |
二氧化硫 |
氢氧化钠 |
| D |
氯化钙 |
一氧化氮 |
氢氧化钠 |
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是

| 选项 |
W |
X |
| A |
盐酸 |
Na2CO3溶液 |
| B |
Cl2 |
Fe |
| C |
CO2 |
Ca(OH)2溶液 |
| D |
NaOH溶液 |
AlCl3溶液 |
下列叙述正确的是
①向久置于空气中的NaOH溶液中加盐酸时有气体产生 ②浓硫酸可用于干燥H2、NO2等气体,但不能干燥NH3、SO2等气体 ③CO2和Na2O2反应生成Na2CO3和O2,SO2和Na2O2反应生成Na2SO3和O2④足量硫单质与64 g铜反应,有2 mol电子发生转移 ⑤蔗糖炭化的演示实验中,浓硫酸既体现了强氧化性又体现了脱水性⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质
| A.①④⑤ | B.①⑤⑥ | C.②③④ | D.④⑤⑥ |
下列工业生产的主要反应中,涉及置换反应的是(
| A.生产粗硅 | B.海水提镁 | C.电解冶铝 | D.生产硫酸 |
类比是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列各种类比推测的说法中正确的是
①已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS
②已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2
③已知CO2分子是直线型结构,推测CS2分子也是直线型结构
④已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
⑤已知NaOH是强电解质,其饱和溶液导电能力很强,Ca(OH)2也是强电解质,推测其饱和溶液导电能力也很强
| A.①③④ | B.①②⑤ | C.③④ | D.③④⑤ |
化学与生活、社会密切相关,下列说法正确的是
| A.SO2和NO2都是有用的化工原料,因此目前都是将汽车尾气中的氮氧化合物收集后制备硝酸以防止污染空气 |
| B.由于HClO具有漂白性,因此工业上常用Cl2的水溶液来漂白纸浆、毛、丝、草帽辫 |
| C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 |
| D.金属钠通常被保存在煤油中,以隔绝空气 |
试题篮
()