有四种物质:①Al2O3、②HNO3、③NaHCO3、④Ba(OH)2。根据要求,回答下列问题:
(1)写出物质④的电离方程式_______________________________。
(2)写出物质②和③反应的离子方程式_______________________________。
(3)既能与强酸反应,又能与强碱反应的物质是____________(填序号)。
某化学兴趣小组对以下三种品牌牙膏中摩擦剂成分进行调查,结果如下表:
| 牙膏品牌 |
两面针儿童牙膏 |
珍珠防臭牙膏 |
中华透明牙膏 |
| 摩擦剂 |
氢氧化铝 |
碳酸钙 |
二氧化硅 |
针对三种磨擦剂回答下列问题:
(1)属于酸性氧化物的是 (填化学式,下同),既能与强酸反应又能与强碱反应的是 。
(2)氢氧化铝与强碱溶液反应的离子方程式是 。
(3)工业上常用碳还原SiO2来制备晶体硅,其反应方程式是 。
按要求填空:
(1)含有相同氧原子数的CO2和CO:物质的量之比为___________;质量之比为______________。
(2)写出除去FeCl3溶液中的FeCl2所需的试剂:_______________(填化学式)
(3)海水的溴以Br-的形式存在,海水中提溴的方法通常是:向苦卤中通入Cl2是为了提取Br2,为
大量富集Br2,常先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收,该反应的离子方程式是 。
①HCl、②过氧化钠、③碳酸氢钠、④二氧化硅是常见的物质。请回答下列问题。
(1)上述4种物质中属于盐的是 (填序号,下同);上述四种物质加入紫色石蕊溶液中,溶液变红的是 。
(2)写出HCl的电离方程式 。
(3)写出过氧化钠与水反应的化学方程式___________________________。
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为______________。
(5)写出二氧化硅与氢氧化钠溶液反应的化学方程式_______________________。
有关物质间转化关系如下图,试回答:
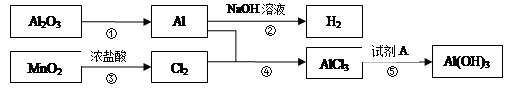
据此判断:
(1)转化①的反应条件为 。
(2)转化②的化学方程式为 。
(3)若转化⑤用于实验室制Al(OH)3,则试剂A宜选择 填名称)。
(4)转化⑤的离子方程式为 。
除去下列不纯物质中的少量杂质(括号内为杂质),请填入适当的试剂
(1)Cu(Al)_________________(2)Fe2O3(Al2O3)___________________
(3)NO(NO2)__________________(4)NaCl溶液(Na2CO3)_______________
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若A是当前最常用的太阳能转换为电能的材料。
(2)C的水溶液俗称水玻璃,D为硅酸。则:写出反应②的化学方程式 。写出反应③的离子方程式 。
(2)若A是应用最广泛的金属。反应①、⑤均用盐酸,D物质是红褐色。则:
写出反应③的化学方程式 。B溶液中加入NaOH溶液的现象是 ,沉淀颜色发生变化对应的化学方程式是 。
C的溶液用于蚀刻印刷铜电路板(铜质),写该反应的离子方程式 。
(3)若D物质是常见的两性氢氧化物,反应②③⑤均要用强碱溶液,反应④是通入过量的CO2。则:反应②的离子方程式为 。反应④的离子方程式为 。
根据题意完成下列方程式
(1)写出实验室制备氨气的化学方程式 ;
(2)写出实验室制备Cl2的离子方程式 ;
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;K2FeO4-Zn可组成碱电池,电池总反应式为:2Fe O42-+8H2O+3Zn=2Fe(OH)3+3Zn(OH)2+4OH-。写出该电池的正极反应式 ;
(1)在模拟溶洞的“形成”实验中,将过量二氧化碳气体通入饱和Ca(OH)2溶液中,产生CaCO3白色沉淀的质量与通入的二氧化碳气体体积之间的关系曲线如图所示。试回答:
AB段曲线所表示的反应化学方程式是: 。

将B处生成的溶液煮沸,反应化学方程式是: 。
(2)已知硫可与热的KOH溶液发生反应,反应方程式如下:3S+6KOH 2K2S+K2SO3+3H2O
2K2S+K2SO3+3H2O
据此回答以下问题:
①在上述反应中,氧化剂与还原剂的物质的量之比为 。
②在上述反应中,若有3 mol硫单质参与反应,则转移电子的物质的量是 mol。
完成下列反应的反应方程式:
(1)NaOH溶液吸收氯气的反应:____________________________
(2)铁与水蒸气在高温下的反应: ____________________________
(3)氢氧化铁溶于盐酸:____________________________
(4)铝单质溶解在氢氧化钠溶液中:____________________________
(5)过氧化钠与二氧化碳反应:____________________________
Ⅰ.请回答:
(1)CO2的电子式
(2)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝。写出该反应的离子反应方程式:
(3)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式: 。
(4)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3)。现取适量这种钴的氧化物,可与480 mL 5 mol·L-1盐酸恰好完全反应,得到CoCl2溶液和6.72 L黄绿色气体(标准状况)。则该反应的化学反应方程式为 。
Ⅱ.下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素。根据以下信息填空:
| 元素 |
相关信息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D |
室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E |
它在地壳中储量丰富,是人体不可缺少的微量元素之一。其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(5)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式:_____________。
(6)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为 ;常温下,E的单质与化合物X反应生成盐Y,Y的化学式是 。化合物Z仅由元素D和E组成, Z+ H2O+ O2= X+ Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式: 。
(7)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成 。
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列各问:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性.
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2
② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu CuO
CuO  Cu(NO3)2
Cu(NO3)2
(3)①在50mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
| A.20.16L | B.6.72L | C.10.08L | D.15.12L |
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(4)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 。
(1)化学与人类生产、生活密切相关。请按要求回答下列问题:
①下列我国古代的技术应用中,其工作原理不涉及化学反应的是 (填字母)
| A.火药使用 |
B.粮食酿酒 |
C.转轮排字 |
D.铁的冶炼 |
 |
 |
 |
 |
②下列用品的有效成分及用途对应错误的是 (填字母)
| |
A |
B |
C |
D |
| 用品 |
 |
 |
 |
 |
| 有效成分 |
NaCl |
NaOH |
NaHCO3 |
Ca(ClO)2 |
| 用途 |
做调味品 |
做治疗胃病的抗酸药 |
做发酵粉 |
做消毒剂 |
③工业上常用氯气和石灰乳反应生产漂白粉,其原理是_________________(用化学方程式表示)。
④在生产中,人们曾用浓氨水来检验氯气管道是否漏气。如果氯气管道某处漏气,用浓氨水检查时就会产生白烟的现象,又知此时发生的是有氮气生成的置换反应,则此时发生反应的化学方程式为____________。
(2)科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究。物质分类及转化思想贯穿整个化学科学习的始终。
①有下列十种物质:
A.空气 B.O2 C.NaHSO4 D.氨水 E.CuSO4·5H2O F.NaOH
G.CO2 H.Fe2O3 I.金刚石 J.H2SO4
其中属于混合物的有 ;属于单质的有 ;属于盐的有 。(填字母)
②有下列六个反应:
A.Cl2+H2O = HCl+HClO
B.Zn + H2SO4 = ZnSO4 + H2↑
C.2Cu2O + Cu2S  6Cu+SO2↑
6Cu+SO2↑
D.Cl2+2KI = 2KCl+I2
E.H2 + Cl2 2HCl
2HCl
F.2KClO3 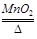 2KCl+3O2↑
2KCl+3O2↑
其中属于置换反应的是 ,既属于分解反应又属于氧化还原反应的是 (填字母)。
③K2FeO4是一种重要的净水剂,可用下列方法制得:
2Fe(OH)3+3Cl2+10KOH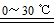 2K2FeO4+6KCl+8H2O
2K2FeO4+6KCl+8H2O
在该反应中,还原剂是 ,当反应中有1mol K2FeO4生成时,转移电子的数目为 。
(3)物质的量是化学计算的核心。请按要求完成下列填空:
①已知3.01×1023个X气体分子的质量为8g,则X气体的摩尔质量是 。
②含0.4 mol Al3+的Al2O3的质量是 。
③某块光卤石(KCl·MgCl2·6H2O)中含5.3250 g Cl—,则该光卤石的物质的量为 。
④标准状况下,224mL的氨气中含有的氢原子数为 。
在如图所示的有关物质转化关系中,各物质均是我们中学化学所学的物质。C为一种黑色粉末,D为一种气体。
请根据框图中物质的转化关系及相关信息,用化学式填写下列空白:
(1)若F为可溶性碱,G为蓝色沉淀,则A为_________________;D可能为__________________。
(2)若G为蓝色沉淀,H为难溶性盐,则I为_________________。
(3)若G、H都属于盐,且G为蓝色溶液,则I可能为______________;F可能为_____________。
试题篮
()