无机化合物A和金属B是中学化学常见的固体,其中A显淡黄色。相同质量的A、B都能与液体C反应放出气体,两气体又能恰好完全反应生成C。利用B在高温下的挥发性,可通过它的碳酸盐和焦炭在真空环境中来制备B。化合物D可作为有机反应中的脱氢试剂,1molD和1mol NH4Cl反应生成2mol气体E和1molB的氯化物。已知标准状况下气体E的密度为0.76g·L-1。
请回答下列问题:
(1)E的化学式为 。
(2)题中制备B的化学方程式为 。下列物质能替代焦炭的是 。
A.Na B.H2 C.KMnO4 D.Cl2
(3)B与E在一定条件下 (填“可能”或“不可能”)直接发生反应产生D,判断理由是 。
氰[(CN)2]为无色可燃气体、剧毒、有苦杏仁味,是拟卤素的一种。拟卤素的性质与卤素相似。
(1)写出氰与苛性钠溶液反应的化学方程式: 。
(2)已知氰分子中键角为180°,分子具有对称性,(CN)2的结构式为 ,(CN)2的分子为(填“极性”或“非极性”) 分子。
(3)CN-中电子数为 。
已知A、B、C、D、E、X存在下图示转化关系(部分生成物和反应条件略)。
(1)若E为,则A与水反应的化学方程式 。表示X溶液呈碱性的离子方程式为 ,用结构式表示C分子: 。
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为 。
(2)若E为常见单质气体,D为白色胶状沉淀,A的化学式可能是 ,B中含有的化学键类型为 ,C与X反应的离子方程式为 。
(3)若A、B均为气体单质,D可与水蒸气在一定条件下发生可逆反应生成C和一种可燃性气体单质,则该可逆反应的化学方程式为 。t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的化学平衡常数K=1,则D的转化率为 。
(9分)有一透明溶液,可能含有Al3+、Fe3+、K+、Mg2+和Cu2+、 CO32-、SO42-等离子中的一种或几种。现加入Na2O2粉末只有无色无味的气体放出,并同时析出白色沉淀。而且加入Na2O2的量与生成白色沉淀的量之间的关系用下图来表示。
试推断:
(1)原溶液中一定含有——————————;
(2)一定不含有————————————————;
(3)可能含有————————;为了进一步确定可能含有的离子,请简述实验操作过程—————————————————————————。
A、B、C、D、E为五种短周期元素。A、B、C是原子序数递增的同周期元素,且最外层电子数之和为15,A与C可形成常见的AC2分子;D元素的某种原子中无中子;E是地壳中含量最高的金属元素。请回答下列问题:
(1)AC2分子的电子式为____________________。
(2)比较BD3与D2C的稳定性:_______比________稳定(填化学式)。
(3)五种元素的原子半径由大到小的顺序是__________________(填元素符号)。
(4)E的单质与NaOH溶液反应生成的盐的溶液与少量AC2反应的离子方程式为___________________。
(5)化合物EB溶于强碱生成氨气,写出EB与NaOH溶液反应的化学方程式______________________。
(6)工业生产的EB产品往往含有碳和氧化铝杂质,现取10 g样品置于反应器中,通入2.016L(标准状况下)O2,在高温下充分反应后,所得气体的密度是相同状况下氢气的15倍(EB不与O2反应)。该样品中含杂质碳的质量分数为______________。
有关元素X、Y、Z、D、E的信息如下
| 元素 |
有关信息 |
| X |
元素主要化合价为—2,原子半径为0.074nm |
| Y |
所在主族序数与所在周期序数之差为4 |
| Z |
原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,产生的气体通入品红中,品红褪色。 |
| D |
最高价氧化物对应的水化物,是强电解质,能电离出电子数相等的阴、阳离子 |
| E |
单质是生活中常见 金属,其制品在潮湿空气中易被腐蚀或损坏 金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 。
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号) 。
①保存EY2溶液时,需向溶液加入少量E单质
②通常实验室配制EY3溶液时,直接用水溶解EY3固体即可
③EY 2只能通过置换反应生成,EY3只能通过化合反应生成
2只能通过置换反应生成,EY3只能通过化合反应生成
④铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)用电子式表示D2Z的形成过程: ,D2Z水溶液显 性
用离子方程式表示其原因
(4)2009年3月,墨西哥、美国等多国连接暴发甲型H1N1型流感,防控专家表示,含Y消毒剂和过氧化物可防甲型H1N1流感。YO2是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KYO3在H2ZO4存在下与D2ZO3反应制得。请写出反应的离子方程式: 。
(5)将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中
有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。
该苛性钾溶液中KOH的质量是 g,该反应中转移电子的物质的量是 mol。
有五种摩尔质量均为44g/mol的化合物甲、乙、丙、丁、戊,均由短周期元素组成。对甲的捕获在降低温室气体排放中具有重要的作用。乙为烃,等物质的量的乙与丁充分燃烧产物为甲与水,且生成水的质量前者是后者的2倍,丙在一定条件下分解获得两种单质,两单质放电时反应生成A,A遇空气变成红棕色气体B。戊是一种极不稳定的物质,在1180℃以下不存在。科学家用质谱仪在工业制硅的反应产物中证实了其存在。
(1)丁的分子式 ,甲的电子式 。
(2)若生成戊的反应中氧化产物与还原产物为同一物质,写出生成戊的化学方程式 。
(3)把铁和铜混和物放入一定量B通入水后形成的稀溶液中,反应后过滤,滤出的固体物质投入盐酸中无气体放出,则滤液中一定含有的溶质是 。
(4)将0.2mol乙完全燃烧后生成的气体全部缓慢通入300mL某浓度的NaOH溶液中,气体完全被吸收,溶液中NaOH无剩余,则NaOH溶液的浓度为 (若有定值则写具体数值,无定值则写范围)。
(5)将等物质的量A、B的混合物溶于NaOH溶液中得到只含有一种溶质的溶液,此溶质的化学式为 ,设计简单实验方案证明溶液中含有此溶质 。
金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质。
(1)钠与水反应时,钠漂浮在水面上。甲同学用刺有小孔的铝箔将4.6g的钠包裹,而后投入到水中,使钠沉入水底与水(足量)反应。该过程中发生反应的离子方程式有___________,充分反应生成的气体体积_________(填“大于”、“小于”或“等于”)2.24L(标准状况下)。
(2)乙同学将足量的铜粉投入到500mL18.4mol/L的浓硫酸中并加热制取SO2,写出该反应的化学方程式__________,生成的SO2物质的量小于4.6mol的原因是_____________。
(3)丙同学向MgCl2、AlCl3的混合溶液中逐滴滴加2mol/L的NaOH溶液,并绘制出沉淀与NaOH溶液体积的关系图像如图,则a=_________,b=________。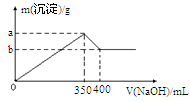
海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素。
(1)氯原子结构示意图是 ,碘在元素周期表中的位置是 ,HI的稳定性比HBr (填写“强”或“弱”)。
(2)向浓缩的海水中通入Cl2,可将Br-转化为Br2。再用“空气吹出法” 将Br2从浓海水中吹出,并用纯碱浓溶液吸收,生成NaBr、NaBrO3等。当有1 mol Br2被纯碱吸收时,转移的电子数为 。
下图是NaClO的发生装置。该装置主要利用了电解饱和食盐水的原理,可实现对海水的消毒和灭藻。
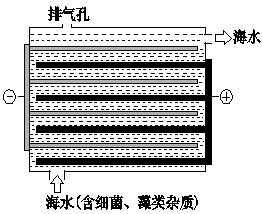
(3)写出装置中产生NaClO的化学方程式 。海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH) 2和CaCO3。 生成CaCO3的离子方程式是 。若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。试用电极反应式并结合必要的文字进行解释 。
NaOH溶液吸收SO2得Na2SO3,可用Na2SO3吸收SO2。在SO2被吸收的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
1:91 |
| pH |
8.2 |
7.2 |
6.2 |
(4)从上表可判断,NaHSO3溶液呈 (填“酸性”、“碱性”、“中性”),请用平衡原理解释: 。
(5)当吸收液呈中性时,溶液中离子浓度关系正确的是 (选填字母)。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
d.c(Na+)>c(SO32-)>c(HSO3-)>c(H+)=c(OH-)
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
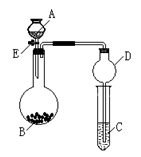
(1)若A为水,B为过氧化钠,C中盛有稀硫酸和FeCl2混合溶液,旋开 活塞E后,C中溶液颜色变化为 ,烧瓶中发生反应的化学方程式为 。
(2)若A为盐酸、B为大理石(主要成分为CaCO3粉末)、C中盛有水玻璃,则小试管中的现象是 ,固体的主要成分为(写化学式)_________________。
(3)利用上述装置可以验证SO2的性质, 若A为浓硫酸,B为亚硫酸钠粉末,那么C中盛有 溶液时可验证其具有漂白性;而C中盛有 溶液时可验证其具有还原性(各填一种物质名称)。
磷化铝是用红磷和铝粉烧制而成。因杀虫效率高、经济方便而应用广泛。可作粮仓熏蒸的磷化铝片,熏蒸每吨粮食只需3~5片(3.20g/片)。
(1)写出磷化铝的化学式:________;举一例红磷的同素异形体,写出其化学式:________。
(2)磷化铝毒性主要为遇水、酸时则迅速分解,放出吸收很快、毒性剧烈的磷化氢气体,写出磷化铝
和水反应的化学方程式:____________________________________________________________。
(3)磷化氢是一种无色、剧毒、易燃的气体,该气体比空气重并有类似臭鱼的味道,其结构和NH3相似,写出磷化氢的电子式:________;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:___________________________________________。
(4)磷化氢在空气中的最高允许值为0.3ppm,空气中超标的PH3气体可以用重铬酸钾、活性炭、氢碘酸处理,你认为他们的反应原理是否相同,原因是____________________________________。
(5)磷的含氧酸很多,H3PO4是常见的一种,多个磷酸分子通过脱水作用由O原子连接而成为多磷酸,三聚磷酸钠(Na5P3O10·6H2O)是常见的多磷酸盐,该盐373K时,可发生如下反应Na5P3O10·6H2O="==" Na3HP2O7+X+5H2O,请你推出X的化学式:__________________;并且写出X溶液中离子电荷守恒的等式:___________________________。
W、X、Y、Z四种短周期元素在周期表中的位置如图所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物。

请回答下列问题。
(1)H2Y2的电子式为______________________,Z在周期表中的位置___________________。
(2)在图中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是_________________________。
(3)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1molNa2Y2固体时,放出热量511kJ。则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为_____________。
(4)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解溶液,则通入Z2的电极为原电池的___________极,其电极反应式为____________________。
U、W、X、Y、Z都是短周期元素,且原子序数依次增大。其中U与W可形成三角锥形分子A,U与X可形成常温下呈液态的分子B,A、B均为10电子分子;Y元素原子的K层电子数与M层电子数相同;Z元素的单质、氧化物均为原子晶体。请回答下列问题:
(1)Z元素在周期表中的位置______________ 。W、X、Y、Z四种元素的原子半径由小到大的顺序是______________ (用元素符号表示)。
(2)用电子式表示U与X形成的18电子化合物的形成过程________ 。
(3)ZX2与NaOH溶液反应的离子方程式 。
(4)一定量的Y单质在足量二氧化碳中充分燃烧的化学方程式是______________,将生成的全部固体与足量的热浓硝酸混合,充分反应后,产物中二氧化碳和二氧化氮共aL(标准状况),则 Y 单质的质量是______________ g(用含a的代数式表示)。
下图中,B、D、E、F、G是氧化物,F和K都是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质,其水溶液与D均具有漂白性。O是白色沉淀,在空气中很容易转化为N,且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品,其工业制备过程包括反应⑤和⑥(图中部分反应物和生成物没有列出)。请按要求回答:
(1)写出L的化学式: 。
(2)写出:反应③的离子方程式 ;
反应④的化学方程式 ;
反应④的现象是 。
(3)反应②在工业生产上的用途是 。
(4)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1:1:1:14,则反应①的化学方程式为 。
周期表中短周期6种元素A、B、C、D、E、F,原子序数依次增大。A的原子半径最小,A和D、C和F分别同主族,F的单质是黄色固体,B所形成的化合物种类最多,E的最外层电子数等于其电子层数。
(1)写出工业制备E单质的化学方程式____________________。
(2)写出一种由其中两种元素组成的既含极性键又含非极性键的18电子微粒________(写化学式)。
(3)由A、C元素组成的化合物甲与由D、C元素组成的化合物乙反应可制备O2,请写出乙的电子式__________。
(4)3mol DABC 和2mol D
和2mol D C
C 混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分及物质的量分别是____________________。
混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分及物质的量分别是____________________。
试题篮
()