现有下列四种物质:① Cl2、②NH3、③ NaHCO3、④FeCl3溶液。其中,与HCl相遇,有白烟产生的是 (填序号,下同),能与水反应,其水溶液有杀菌消毒作用的是 ,受热易分解,能与盐酸反应产生气体的是 ,遇KSCN溶液变为红色溶液的是 。
(12分) 如下图所示,在一个烧瓶中充满气体A,打开①处的止水夹向烧瓶中缓慢通入等体积的气体B后关闭该止水夹,待充分反应后再打开②处的止水夹。
(1)请按要求填表回答打开②处的止水夹前烧瓶中所观察到的现象并按要求书写反应的化学方程式:
(2) 打开②处的止水夹后,烧瓶内剩余气体最多的是(填实验序号)____________。
X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收。已知X是化石燃料燃烧产物之一,是形成酸雨的主要物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,能与水反应。请写出下列物质反应的化学方程式。
⑴ X在一定条件下与氧气反应__ ______
⑵ Y与氢氧化钠溶液的反应_____ ________
⑶ Z与水的反应___ _______________
按要求进行书写:
(1)氯化钡的电离方程式:___________
(2)氢氧化亚铁在空气中被氧化的化学方程式:___________
(3)过氧化钠与水反应的化学方程式:___________
(4)在化学方程式上用双线桥法表示电子转移的方向及数目:
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)把下列式子改成氧化物形式
①正长石(KAlSi3O8)
②蛇纹石(H4Mg3Si2O9)
(2)写出下列物质间的关系:红磷与白磷 ,
35Cl和37Cl
(3)写出除去括号中杂质的方法:
碳酸钠固体(碳酸氢钠晶体)
SiO2固体 (CaO)
CO2 (SO2 )
(4)写出稀硝酸与金属银在加热条件下反应的离子方程式:
将PbO2放入浓盐酸中会产生Cl2,此反应的化学方程式为:
(5)标准状况下,在三个容积相同的干燥的烧瓶中,甲瓶装入干燥纯净的NH3,乙瓶装入含四分之一体积空气的HCl,丙瓶装入NO2和O2(体积比为4:1),以水为溶剂作喷泉实验。实验结束后三个烧瓶中溶液的物质的量浓度之比为 ,丙瓶中发生反应的总化学方程式为
干燥的氨气可与 等液体物质(至少选填两种)一起组装成功喷泉实验;向烧杯中的FeSO4溶液中滴加NaOH溶液,然后烧杯静置在空气中,可观察到的现象是 ;有关反应的化学方程式或离子方程式为:
① ② ;
向新制氯水中滴加AgNO溶液,现象是 ,相应的离子方程式为
① ② ;
A、B、C、D、E五种元素均是短周期的主族元素,原子序数依次增大。B、E原子的最外层电子数均为其电子层数的两倍,D、E元素原子的最外层电子数相等。X、Y、Z、W均由上述元素的两种元素组成,甲、乙均由上述元素的三种元素组成。元素B形成的单质M与甲、乙均能反应(相对分子质量甲<乙)。转化关系如图(反应条件略去)。请回答下列问题:
(1)X、Y、Z、W属于同一类物质,这类化合物可称为 ;X、Y、W都能与Z反应,则Z为 (写化学式)。
(2)写出M与甲的浓溶液、M与乙的浓溶液加热时反应的化学方程式:
① ;② 。
(3)化合物BE2与化合物Y结构相似,则BE2的电子式为 。
(4)上述六种化合物中 是空气质量日报必须分析测定的物质,他们的危害是 。(写一种及对应危害即可)
(5)将X、W与D按1:1:n通入Z中,充分反应后无气体剩余或生成,写出反应的化学方程式 。
(17分) 现有下列十种物质:
①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2
⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 |
金属单质 |
氧化物 |
溶液 |
胶体 |
电解质 |
| 属于该类的物质 |
|
|
|
|
|
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-= H2O,该离子反应对应的化学方程 式为__________________________________________________________。
式为__________________________________________________________。
(3)⑩在水中的电离方程式为__________________________________________________,
(4)少量的④通入⑥的溶液中反应的离子方程式为________________________________。
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是____________(填化学式),氧化剂与还原剂的物质的量之比是_____________,当有5.4g Al发生反应时,转移电子的物质的量为_________________。该反应的离子方程式为___________________________________________________。
(10分) 按要求填空
(1) 配平下列化学方程式:
______P + ________FeO + _______CaO =_______Ca3(PO4)2 +_________Fe
(2) 制造光导纤维的材料是_________;三硅酸镁(Mg2Si3O8·11H2O)用氧化物表示_______________________。
(3) 除去NaHCO3溶液中少量的Na2CO3杂质相应的离子方程式为__________________________________________。
(4) 检验SO42-所需要用的试剂__________________和__________________。
在MgCl2溶液中滴加少量NaOH溶液,现象为 ,继续加入过量的NaOH溶液,现象为 ;在AlCl3溶液中滴加少量NaOH溶液,现象为 ,继续加入过量的NaOH溶液,现象为 。
由于空气中,按体积计算,氧气约占 ,所以硫在空气中燃烧,发出 色火焰,而在纯氧中燃烧,则发出 色火焰。生成的气体叫做 ,具有 气味。
喷泉是一种常见的自然现象,其产生原因是存在压强差。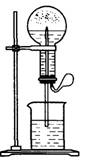

图1 图2
(1)图1为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是____
A. HCl和H2O B. O2和H2O C. NH3和H2O D. CO2和NaOH
(2)某学生积极思考产生喷泉的其他办法,并设计了如图2所示的装置。
①在图2的锥形瓶内,分别加入足量下列物质,反应后可能产生喷泉的是__________
A. Cu与稀盐酸 B. NaHCO3与NaOH
C. CaCO3与稀硫酸 D. NH4HCO3与稀盐酸
②在图2的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冰水后,再加入足量的下列物质,结果也产生了喷泉,水槽中加入的物质可以是_______
A. 浓硫酸 B. 食盐 C. 硝酸钾 D. 硫酸铜
③比较图1和图2两套装置,从产生喷泉的原理来分析,图1是_______上部烧瓶内气体压强,图2是_______下部锥形瓶内气体压强(均填“增大”或“减小”)
(3)城市中常见的人造喷泉及火山喷发的原理与上述__________(填“图1”或“图2”)装置的原理相似。
按要求填空:
(1)除去NaHCO3溶液中的少量Na2CO3,方法是: ;离子方程式为: 。
(2)呼吸面具中所用的药品是 ;反应的化学方程式为: 。
(3)由铝盐制取氢氧化铝,所用的试剂为: ;离子方程式为: 。
(4)白色的Fe(OH)2在空气中发生的颜色变化为 。
(5)写出硅酸钠溶液在空气中变质的化学方程式: 。
(6)写出用熟石灰吸收氯气制漂白粉的化学方程式: 。
(7)将CaMg3Si4O12改写为氧化物的形式: 。
现有下列四种物质:① SiO2、② NH3、③ Na2CO3、④ Al2(SO4)3。其中,俗称为“苏打”的是____(填序号,下同),极易溶于水的气体是____,向其溶 液中,逐滴加入氢氧化钠溶液,先产生白色沉淀,后沉淀溶解的是__ __,为石英主要成份的是__ __
液中,逐滴加入氢氧化钠溶液,先产生白色沉淀,后沉淀溶解的是__ __,为石英主要成份的是__ __
硫--碘循环分解水制氢主要涉及以下反应
I
Ⅱ
Ⅲ
(1)分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行 b.反应I中氧化性比
强
c.循环过程中需补充 d.循环过程中产生1
的同时产生1
(2)一定温度下,向1密闭容器中加入1
,发生反应Ⅱ,
物质的量随时间的变化如图所示。

0-2已见分晓的平均反应速率
=,该温度下,
的平衡常数
=。
相同温度下,若开始加入的物质的量是原来的2倍,则是原来的2倍。
a.平衡常数 b.的平衡浓度 c.达到平衡的时间 d.平衡时
的体积分数
(3)实验室用和稀硫酸制
,反应时候溶液中水的电离平衡移动(填"向左"或"向右"或"不");若加入少量下列试剂中的,产生
的速率将增大。
A. B.
C.
D.
(4)以为燃料可制作氢氧燃料电池。已知
某氢氧燃料电池释放228.8电能时,生成1
液态水,该电池的能量转化率为。
试题篮
()