(9分) 在下列物质转化中,已知A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸;当X无论是强酸还是强碱时,都有如下的转化关系:
说明:当X是强酸时A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。(已知H2CO3、H2S、H2SO3、H2SiO3皆为二元弱酸)
请回答下列问题:
(1)A是 ,Y是 ,Z是 (填化学式,下同)。
(2)当X是强酸时,E是 ,写出B生成C的化学方程式: _____ 。
(3)当X是强碱时,E是 ,写出D生成E的离子方程式: 。
钙、镁、铝等的化合物在生产生活中有着广泛的应用。甲、乙两研究小组分别对石灰乳吸收硝酸工业的尾气、碱式碳酸镁铝[MgaAlb(OH)c(CO3)d·xH2O]的有关问题进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲组利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得有广泛应用的Ca(NO2)2,其部分实验流程如下:
①大量氮氧化物排放到空气中,会破坏臭氧层,形成酸雨等,由氮氧化物形成的酸雨称为是_________(填“硫酸”或“硝酸”)型酸雨。过滤操作中,需要使用的玻璃仪器有烧杯、玻璃棒和_______________。
②上述流程中采用“气一液逆流接触”吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是_________________;滤渣可循环使用,滤渣的主要成分是________。
(2)乙组查阅有关资料知道碱式碳酸镁铝受热容易分解,因此在生产生活中常用作塑料阻燃剂。
①MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为______________________。
②根据你的理解,你认为碱式碳酸铝镁具有阻燃作用的可能原因主要是由于其受热分解需吸收大量热量和_______________________________。
③为确定碱式碳酸铝镁的组成,进行如下实验:准确称取6.780 g样品与足量稀盐酸充分反应,生成CO2 1.120 L(已换算成标准状况下)。另取一定量样品在空气中加热,样品的固体残留率随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上残留固体为金属氧化物的混合物)。
注意:固体残留率是指 。则在270℃~600℃之间,物质受热分解放出的气体是__________(填化学式)。6.780 g样品中,除结晶水外还含有的氢原子的物质的量是__________mol。
。则在270℃~600℃之间,物质受热分解放出的气体是__________(填化学式)。6.780 g样品中,除结晶水外还含有的氢原子的物质的量是__________mol。
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是_____________, X属于的晶体类型是_________。
②将4.48 L(标准状况下)X通入100mL 3 mol/L A的水溶液后,溶液中发生的离子反应方程式为______。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为______ g
常见金属单质A可发生如图所示转化(部分反应物、产物和反应条件已略去)。F是一种温室气体;气体G的水溶液显弱碱性;H是一种具有磁性的黑色氧化物;B、C、D、E四种化合物中含有一种相同的元素。
请回答下列问题:
(1)写出F的电子式________________,实验室制取G的化学方程式为______________________。
(2)写出反应I的离子方程式_______________。该反应中的氧化剂是______________________。
(3)反应I、Ⅱ均有清洁能源H2产生。已知H2的燃烧热为286 kJ·mol-1,18 g水蒸气变成液态水放出44 kJ的热量。其它相关数据如下表:
则表中x为______________
(4)写出A与H反应的化学方程式________________________________,实验测得该反应的焓变(△H)和活化能(Ea)。下列能量关系图合理的是_________________(填写序号)。
(5)资料显示H可用于除去地下水中的TcO4-(99Tc具有放射性)。在酸性条件下,H将TcO4-转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱,该反应的离子方程式为_______________________________。
Ⅰ:现有如下物质:①酒精、②铜、③氢氧化钡、④氨气、⑤蔗糖、 ⑥高氯酸、⑦碳酸氢钠、⑧磷酸、⑨硫化氢、⑩Al2(SO4)3。请用物质的序号填写下列空白
(1)属于强电解质的有: 。
(2)液态时能导电且为物理变化的有: 。
(3)⑦在水溶液的电离方程式为 。
Ⅱ:A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。处理C物质可得到有价值的化学品,写出该化学品中的1种酸和1种盐的名称 、 。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气主要成分,写出该反应的化学方程式 。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是___ _____。写④反应离子方程 。
(4)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式 。
(本题共12分)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:
36、在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发、_________、洗涤等步骤;有关其中“蒸发”步骤的叙述错误的是____________。
a. 蒸发的目的是得到热饱和溶液
b. 蒸发的目的是析出晶体
c. 应用余热蒸干溶液
d. 应蒸发至有较多晶体析出时为止
37、由MgCl2溶液得到MgCl2·6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是_________。
a. 得到热饱和溶液 b. 析出晶体
38、若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:___________________;用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
39、该流程产生的物质中,除Ca2+能被海洋生物利用外,还需综合利用的物质是_________。
40、MgCl2可电解制Mg,MgO则是重要的耐火材料。在550℃时,MgCl2·6H2O会分解生成MgO、MgCl2、HCl和水,若不补充其它原料,使一定量的MgCl2·6H2O全部生成a mol MgO、b mol MgCl2和36.5%的盐酸,则a:b≈______________(取整数值)。
A~K为中学化学的常见物质,它们之间有如下图所示的转化关系(反应条件已略去)。已知:通常状况下,A是淡黄色固体,B、D和I都是无色气体单质,F是红棕色气体,H是金属单质。
回答下列问题:
(1)写出化学式A______,F_______,G_______,H_______,J________,K________,。
(2)写出实验室制取K的化学方程式__________________________________________。
(3)写出G→E的化学方程式_________________________________________________;
此反应中,氧化剂和还原剂的物质的量之比是_____________;
0.3mol Cu完全反应,被还原的G为_____________mol。
(4)检验C中阳离子的实验方法是____________________________________________。
(5)实验室中保存的C溶液可能会变质,为了检验C溶液是否变质,分别取少量样品进行如下实验,其中能达到实验目的的是__________(填序号)。
a.向样品中滴加稀硝酸,观察现象
b.向样品中滴加氢氧化钡溶液,观察现象
c.向样品中滴加酚酞试液,观察现象
d.向样品中滴加氯化镁溶液,观察现象
Ⅰ.请回答:
(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝。写出该反应的离子反应方程式: 。
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式: 。
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3)。现取适量这种钴的氧化物,可与480 mL 5 mol·L-1盐酸恰好完全反应,得到CoCl2溶液和6.72 L黄绿色气体(标准状况)。则该反应的化学反应方程式为 。
Ⅱ.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素。根据以下信息填空:
| 元素 |
相关信息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D |
室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E |
它在地壳中储量丰富,是人体不可缺少的微量元素之一。其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(4) C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为 ;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是 。化合物Z仅由元素D和E组成, Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式: 。
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成 。
(12分)下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一。
请回答下列问题:
(1)H中含有的化学键类型是_________________。
(2)上述框图所示的反应中,既属于化合反应,又属于氧化还原反应的反应共有______个;反应③的离子方程式_____________。
(3)25℃时,以Pt为电极电解含有少量酚酞的F的饱和溶液,若在溶液变红的一极收集到0.2 g气体,则此时溶液的pH是_______(假设溶液的体积为2 L且不考虑电解后溶液体积的变化)。
(4)J溶液显_______(填“酸”、“碱”或“中”)性,原因是_________________________。(用离子方程式表示)
金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质。
(1)钠与水反应时,钠漂浮在水面上。甲同学用刺有小孔的铝箔将4.6g的钠包裹,而后投入到水中,使钠沉入水底与水(足量)反应。该过程中发生反应的离子方程式有___________,充分反应生成的气体体积_________(填“大于”、“小于”或“等于”)2.24L(标准状况下)。
(2)乙同学将足量的铜粉投入到500mL18.4mol/L的浓硫酸中并加热制取SO2,写出该反应的化学方程式__________,生成的SO2物质的量小于4.6mol的原因是_____________。
(3)丙同学向MgCl2、AlCl3的混合溶液中逐滴滴加2mol/L的NaOH溶液,并绘制出沉淀与NaOH溶液体积的关系图像如图,则a=_________,b=________。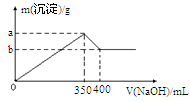
海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素。
(1)氯原子结构示意图是 ,碘在元素周期表中的位置是 ,HI的稳定性比HBr (填写“强”或“弱”)。
(2)向浓缩的海水中通入Cl2,可将Br-转化为Br2。再用“空气吹出法” 将Br2从浓海水中吹出,并用纯碱浓溶液吸收,生成NaBr、NaBrO3等。当有1 mol Br2被纯碱吸收时,转移的电子数为 。
下图是NaClO的发生装置。该装置主要利用了电解饱和食盐水的原理,可实现对海水的消毒和灭藻。
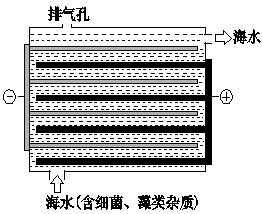
(3)写出装置中产生NaClO的化学方程式 。海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH) 2和CaCO3。 生成CaCO3的离子方程式是 。若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。试用电极反应式并结合必要的文字进行解释 。
NaOH溶液吸收SO2得Na2SO3,可用Na2SO3吸收SO2。在SO2被吸收的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
1:91 |
| pH |
8.2 |
7.2 |
6.2 |
(4)从上表可判断,NaHSO3溶液呈 (填“酸性”、“碱性”、“中性”),请用平衡原理解释: 。
(5)当吸收液呈中性时,溶液中离子浓度关系正确的是 (选填字母)。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
d.c(Na+)>c(SO32-)>c(HSO3-)>c(H+)=c(OH-)
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
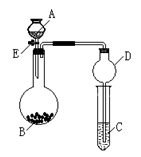
(1)若A为水,B为过氧化钠,C中盛有稀硫酸和FeCl2混合溶液,旋开 活塞E后,C中溶液颜色变化为 ,烧瓶中发生反应的化学方程式为 。
(2)若A为盐酸、B为大理石(主要成分为CaCO3粉末)、C中盛有水玻璃,则小试管中的现象是 ,固体的主要成分为(写化学式)_________________。
(3)利用上述装置可以验证SO2的性质, 若A为浓硫酸,B为亚硫酸钠粉末,那么C中盛有 溶液时可验证其具有漂白性;而C中盛有 溶液时可验证其具有还原性(各填一种物质名称)。
磷化铝是用红磷和铝粉烧制而成。因杀虫效率高、经济方便而应用广泛。可作粮仓熏蒸的磷化铝片,熏蒸每吨粮食只需3~5片(3.20g/片)。
(1)写出磷化铝的化学式:________;举一例红磷的同素异形体,写出其化学式:________。
(2)磷化铝毒性主要为遇水、酸时则迅速分解,放出吸收很快、毒性剧烈的磷化氢气体,写出磷化铝
和水反应的化学方程式:____________________________________________________________。
(3)磷化氢是一种无色、剧毒、易燃的气体,该气体比空气重并有类似臭鱼的味道,其结构和NH3相似,写出磷化氢的电子式:________;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:___________________________________________。
(4)磷化氢在空气中的最高允许值为0.3ppm,空气中超标的PH3气体可以用重铬酸钾、活性炭、氢碘酸处理,你认为他们的反应原理是否相同,原因是____________________________________。
(5)磷的含氧酸很多,H3PO4是常见的一种,多个磷酸分子通过脱水作用由O原子连接而成为多磷酸,三聚磷酸钠(Na5P3O10·6H2O)是常见的多磷酸盐,该盐373K时,可发生如下反应Na5P3O10·6H2O="==" Na3HP2O7+X+5H2O,请你推出X的化学式:__________________;并且写出X溶液中离子电荷守恒的等式:___________________________。
W、X、Y、Z四种短周期元素在周期表中的位置如图所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物。

请回答下列问题。
(1)H2Y2的电子式为______________________,Z在周期表中的位置___________________。
(2)在图中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是_________________________。
(3)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1molNa2Y2固体时,放出热量511kJ。则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为_____________。
(4)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解溶液,则通入Z2的电极为原电池的___________极,其电极反应式为____________________。
U、W、X、Y、Z都是短周期元素,且原子序数依次增大。其中U与W可形成三角锥形分子A,U与X可形成常温下呈液态的分子B,A、B均为10电子分子;Y元素原子的K层电子数与M层电子数相同;Z元素的单质、氧化物均为原子晶体。请回答下列问题:
(1)Z元素在周期表中的位置______________ 。W、X、Y、Z四种元素的原子半径由小到大的顺序是______________ (用元素符号表示)。
(2)用电子式表示U与X形成的18电子化合物的形成过程________ 。
(3)ZX2与NaOH溶液反应的离子方程式 。
(4)一定量的Y单质在足量二氧化碳中充分燃烧的化学方程式是______________,将生成的全部固体与足量的热浓硝酸混合,充分反应后,产物中二氧化碳和二氧化氮共aL(标准状况),则 Y 单质的质量是______________ g(用含a的代数式表示)。
试题篮
()