A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系。
(1)若下列反应①为不同短周期、不同主族元素间置换反应,A、D为固体单质,其中D为非金属。则反应①的化学方程式为

(2)若下列反应②中E为一种一元强碱, C的大量排放产生温室效应。则在反应②中,若C、E的物质的量之比为11:17,则反应的离子方程式为

(3)若下列反应③中B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中E的循环。则B的电子式为 反应③的化学方程式为

已知A为单质,B、C、D、E为化合物,它们之间存在如下转化关系:

(1)若A为非金属单质,B为镁条在空气中燃烧的产物之一,其与水反应可生成气体C,D为无色气体,在空气中可变成红棕色,C与HCl气体反应生成E时产生大量白烟,则B的化学式为 ,由C转化为D的化学方程式为 ,上述反应中属于氧化还原反应的有 。
(2)若A为生活中常见的金属单质,B为A与盐酸反应的产物,C可通过单质间的化合反应制得,加热蒸干并灼烧C的溶液可得到红棕色的D,将C滴入沸水中可得E的胶体,则由B转化为C的离子方程式为 ,加热蒸干并灼烧C的溶液可得D的原因是 。
下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。

根据图示回答问题:
(1)按要求写出下列化学用语:若B原子中子数比质子数多1,则B的原子符号为 ;C的电子式为 ,若D最外层只有两个电子,则D的原子结构示意图 ;
(2)写出反应①的化学方程式是 ;
写出反应②的化学方程式并标出电子转移的方向和数目
(3)J与稀硝酸反应的离子方程式是 ;用排水法收集满该反应的还原产物后,将试管倒扣在水槽中并通入O2使试管刚好全部充满水,假设液体不外溢,则所得溶液的物质的量浓度为 。
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答下列问题: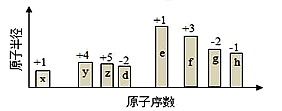
(1)f 在元素周期表的位置是__________。
(2)比较y、g、h最高价氧化物对应水化物的酸性强弱是:_______>________>_______。(用化学式表示)
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,其电子式为__________;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为____________。(填序号)
| A.MnO2 | B.FeCl3 | C.Na2SO3 | D.KMnO4 |
 (4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: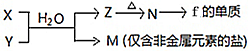
①
 X溶液与Y溶液反应的离子方程式为__________________________
X溶液与Y溶液反应的离子方程式为__________________________
②常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至________________
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1mol·L-1 R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀的物质的量随NaOH溶液体积变化如图所示: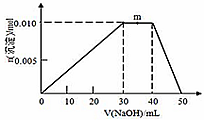
①写出m点反应的离子方程式____________。
②若R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____________mol。
(Ⅰ)A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题。

(1)已知常温下A为有色气体。若F是一种金属单质,写出B和适量F反应生成C与气体E的离子方程式_______________________;
(2)若A为双原子分子,C为直线型分子,E具有漂白性,物质F焰色反应呈黄色.则F的化学式为_____________________。
(3)若A为淡黄色固体,则A与水反应的化学方程式为_________________。
①若物质B和D的式量相等,D为淡黄色固体物质,C的大量排放往往会造成严重的环境问题即_______________。C与F反应的化学方程式为________________;
②若物质A和D的式量相等,D为白色絮状沉淀,写出C与F反应的离子方程式_________________________。
(Ⅱ)亚磷酸(H3PO3)是二元弱酸,与足量NaOH溶液反应,生成Na2HPO3。
(1)根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7(填“>”“<”或“=”)。常温下,向10mL0.01 mol·L-1H3PO3溶液中滴加10mL0.02 mol·L-1NaOH溶液后,溶液中各种离子浓度由大到小的顺序是_________ ;
(2)亚磷酸具有强还原性,可将Cu2+还原为金属单质,亚磷酸与硫酸铜溶液反应的方程式为______.
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X的原子结构示意图为________________ Y原子核外价电子排布图 ________________。
(2)XZ2与YZ2分子的立体结构分别是________和________________,相同条件下两者在水中的溶解度较大的是__________(写分子式),理由是_________________________。
(3)Q的元素符号是__________,它的基态原子的核外电子排布式为______________,在形成化合物时它的最高化合价为__________。
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键_____________________。
下图中X、Y、Z为单质,其他化合物,它们之间存在有如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应.回答下列问题:
(1)组成单质Y的元素在周期表中的位置是________________;R的化学式是________。
(2)写出A和D的稀溶液反应生成G的离子方程式______________________。
(3)向含4mol D的稀溶液中,逐渐加入X粉末至过量.假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值_____________。
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色, A、B、C、D之间有如下图所示的转化关系:
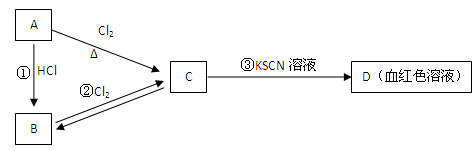
试回答下列问题:
(1)A是 ,C是 (填化学式)
(2)B的溶液与NaOH溶液混合的现象是
相应的化学方程为 、 。
(3)反应①的反应类型是 反应(选填“化合”、“分解”、“置换” “复分解”)。
(4)写出反应②的离子方程式 。
甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。(已知E的电解有氢气和氧气产生)
请回答下列问题:
(1)用化学式表示:丙为__________,H为__________。
(2)A的电子式为________________________________。
(3)向E溶液中通入过量C的化学反应方程式为_____________________。
(4)写出B+C D的化学方程式:_________________________________
D的化学方程式:_________________________________
写出E+G F的离子方程式:______________________________________
F的离子方程式:______________________________________
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y2是空气主要成分之一。请回答:
(1)Q元素在周期表中的位置_______________________;
(2)这五种元素原子半径从大到小的顺序为_______________________(填元素符号)
(3)元素的非金属性Z_________Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有___________(填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与它的低价氧化物反应的化学方程式为_____________________
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式____________;实验室制备气体A的化学方程式 B的水溶液不呈中性的原因___________________(用离子方程式表示)
(6)若使A按下列途径完全转化为F:

①F的化学式为_____________;
②C→F过程中氧化剂与还原剂的物质的量之比为_____________。
已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如下图所示的反应,甲是常见的黑色固体单质,可为生产生活提供热能,乙是常见的无色气体单质,B是无色有刺激性气味的气体,是主要的大气污染物之一,常温下,C是一种无色液体.
请回答下列问题
(1)C的化学式_________;
(2)D的电子式_________;
(3)写出C+E→F+乙的离子方程式_________;
(4)写出B+C+乙→A的化学方程式并用单线桥表示电子转移的方向和数目_________;
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。
请填写下列空白:
(1) 在周期表中,组成单质I的元素位于第__________周期_________族。
(2) 在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
(3) 在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是__________(填序号)
(4) 反应④的离子方程式是__________________________________。
(5) 将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾), 同时还生成KNO2和H2O。该反应的化学方程式是 _________________________。
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则反应②的离子方程式是________________________。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为________________________________。
(3)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为______________。某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:________________。
工业上利用H2SiF6溶液制备BaF2,同时可得到副产品SiO2,其工艺如下:

已知:焙烧过程的反应为(NH4)2SiF6 + BaCO3 BaSiF6 + 2NH3↑+ CO2↑+H2O↑
BaSiF6 + 2NH3↑+ CO2↑+H2O↑
(1)焙烧的气体产物能恰好完全反应生成物质A,则A的化学式为 。
(2)氨解反应为放热反应,且反应能进行完全。该反应需降温冷却的原因为 、 。
(3)热解的另一产物是含两种元素的气体,该气体水解的化学方程式是 。
(4)SiO2可用于制作 ,该物质在信息传输中具有重要应用。
(5)为保持该过程的持续循环,每生成1 mol BaF2,理论上需补充原料H2SiF6 mol。
试题篮
()