对溴苯乙烯与丙烯的共聚物是一种低毒、热稳定性好的高分子阻燃剂。完成下列填空:
(1)写出该共聚物的结构简式
(2)实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体
写出该两步反应所需的试剂及条件 、
(3)将 与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为 .由上述反应可推知,由A生成对溴苯乙烯的反应条件为 .
与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为 .由上述反应可推知,由A生成对溴苯乙烯的反应条件为 .
(4)丙烯催化二聚得到2,3﹣二甲基﹣1﹣丁烯,B与2,3﹣二甲基﹣1﹣丁烯互为同分异构体,且所有碳原子处于同一平面.写出B的结构简式
设计一条由2,3﹣二甲基﹣1﹣丁烯制备B的合成路线
(合成路线常用的表示方式为:A B…
B… 目标产物)
目标产物)
选做[有机化学]]邻羟基桂皮酸(IV)是合成香精的重要原料,下列为合成邻羟基桂皮酸(IV)的路线之一
试回答:
(1)I中含氧官能团的名称 和 。
(2)II→III的反应类型 。
(3)①IV与乙醇和浓硫酸混合加热的化学方程式 。
②IV与过量NaOH溶液反应的化学方程式 。
(4)有机物X与IV互为同分异构体,且X有如下特点:
① 是苯的对位取代物, ② 能与NaHCO3反应放出气体 ,③能发生银镜反应。
请写出X的一种结构简式 。
(12分)I 选择下列实验方法分离提纯物质,将分离提纯方法的序号填在横线上。
| A.萃取分液 |
| B.升华 |
| C.重结晶 |
| D.分液 |
E.蒸馏
F.过滤
G.洗气
(1) 分离饱和食盐水与沙子的混合物。
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
(3) 分离水和汽油的混合物。
(4) 分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
(5) 除去混在乙烷中的乙烯。
(6) 提取碘水中的碘。
Ⅱ 下图是某烃A分子的球棍模型。回答下列问题:
(1)A的名称是________________________;
(2)A能够发生的反应类型有____________(填序号);
a.氧化反应 b.加成反应 c.消去反应
(3)A与溴的四氯化碳溶液反应的化学方程式是 。
(1)某共价化合物分子中只含有C、N、O、H四种元素,且以n(C)、n(N)和n(O)分别表示C、N和O的原子数目。则H原子数目最多等于 。试写出当n(C)=2时,相对分子质量最小的分子的一种结构简式 。
(2)共价化合物含C、H、N三种元素。分子内有四个N原子,且排成四面体,每两个N原子间都含有1个C原子。又知分子中化学键均为单键,则该化合物分子式为 。
(3)碳正离子(例如:CH3+、CH5+、(CH3)3C+等)是有机反应中间体,CH5+碳正离子是由CH4在“超强酸”中获得一个H+而得到,而CH5+失去H2可得CH3+。
①(CH3)2CH+在NaOH水溶液中反应得电中性的有机分子(含氧),其结构简式为 。
②(CH3)3C+去掉H+后生成电中性有机分子,该分子的名称为 。
(4)烯烃可以被酸性的高锰酸钾氧化。已知:在高锰酸钾的氧化下,CH2=CH2→CO2,(CH3)2C=CH(CH3)→  现有1mol某烯烃分子被酸性高锰酸钾溶液氧化后得到2molCO2,和1mol
现有1mol某烯烃分子被酸性高锰酸钾溶液氧化后得到2molCO2,和1mol 。请写出该烯烃分子发生加聚反应的化学方程式 。
。请写出该烯烃分子发生加聚反应的化学方程式 。
已知:
完成下列填空:
(1)分子式为C8H8的某烃,在臭氧作用下发生反应为:
则该烃的结构简式为______________________________________。
(2)若分子式为C8H8的某烃其一氯代物只有一种,写出1种其可能的结构简式_________。
分子式为C8H8的烃有很多,其中有一种苯乙烯,性质活泼,易被氧化,是合成橡胶和塑料的单体,用途广泛。苯乙烯可以通过下列途径制备(反应条件下所有物质均呈气态):
(3)上述流程中各物质,属于苯的同系物的是__________(填结构简式);能与溴水发生加成反应的是_________________________(均填结构简式)
(4)反应①是强吸热可逆反应。要既快又多地获取苯乙烯,反应①适宜条件是__________;为了进一步提高反应物的转化率,有研究者用加入O2与H2反应的方法获取了更多的苯乙烯,试推测其中的原因___________(写出一条)。
完成下列各小题。

(1)系统命名: ;
(2)写出支链只有一个乙基且式量最小的烷烃的结构简式 ;
(3)指出下列各组物质之间的关系(填写编号)
A.同种物质 B.同分异构体 C.同系物
①2-甲基戊酸与丁酸 ;
②新戊烷与2,3-二甲基丙烷 ;
③对羟基苯甲醛与甲酸苯酚酯 ;
④丙烯醇与丙酮 ;
(4)写出下列化学方程式
①丙烯加聚 ;②乙醛与银氨溶液水浴加热 ;
(5)篮烷的结构如右图所示:

①篮烷的分子式为_________________;
②篮烷不具有的性质___ _____;
a.不能溶于水 b.密度大于水
c.能与溴水发生加成反应 d.常温、常压下为气体
③蓝烷的一氯代物有________种
食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯( )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4—CH===CH—CH2—CH===CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是_________。
| A.分子式为C18H34O2 |
| B.一定条件下能与乙酸发生酯化反应 |
| C.能和NaOH溶液反应 |
| D.能使酸性KMnO4溶液褪色 |
(3)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式:_________________。
(4)三类营养物质之一的淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作、现象和结论:______________________________________________。
环己烯 又名四氢化苯,回答下列问题
又名四氢化苯,回答下列问题
(1) 推测环己烯_______(能、不能)使酸性高锰酸钾溶液褪色。
(2) 环己烯属于__________
| A.乙烯的同系物 | B.苯的同系物 |
| C.碳氢化合物 | D.己烯的同分异构体 |
E、芳香烃
(3) 将环己烯与溴的四氯化碳溶液混合充分震荡后,溴的四氯化碳溶液褪色,
写出反应的化学方程式___________________,反应类型为___________
(4) 已知环己烯与水在一定条件下可以发生加成反应生成A,A中含氧官能团名称为____________。
四苯基乙烯是一种在建筑及医疗设备、包装和电器制造中使用的化合物,结构如图。它的一氯代物有 种,分子中能共面的碳原子最多有 个。
乙烯有如下转化关系。乙烯在不同的条件下可被氧化成不同产物,如A、B、C。已知:取0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体。C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀。
完成下列填空:
(1)工业上用石油得到乙烯的方法是 。
A.分馏 B.干馏 C.裂解 D.裂化
(2)A中官能团的名称为 ;写出C的结构简式 。
(3)乙烯到D的化学方程式为 ,反应类型是 。
(4)一定条件下,B能与H2O化合生成A,写出该过程的化学方程式 。
Br2与CH2=CH2加成的反应历程,一种看法是:Br2分子在极性物质环境下破裂为溴正离子(记为Br+)和溴负离子(Br-),加成反应的第一步是Br+首先和CH2=CH2一端结合,而后才是Br-加到CH2=CH2分子的另一端。有人为了证明上述过程,曾在有NaCl、NaI的水溶液中进行乙烯和Br2的反应,他用化学或光谱方法很快检测到三种新有机物,因而肯定了上述反应过程是正确的。试写出三种新有机物的结构简式: 、
、 。
A是一种重要的化工原料,它的产量可以衡量一个国家石油化工水平的高低。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。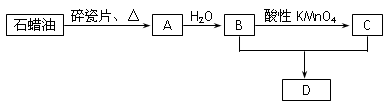
(1)工业上,由石油获得石蜡油的方法是_________,由石蜡油获得A是________变化。
(2)写出A→B的反应方程式: 该反应的类型是____________________写出反应B+C→D的化学方程式:____________________________
该反应的类型是 。
(3)使1molA与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是 mol
(4)实验室制备D的实验装置图如图所示:收集产物的试管中盛放的液体为 ;该溶液的作用有:①除掉产物中的 和 杂质;② 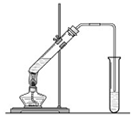
(5)在制备乙酸乙酯过程中,往往加入的乙酸和乙醇的量要比理论计算量多得多,请解析其中可能存在的原因:
①________________________
②________________________
乙烯是一种重要的化工原料, 以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):
以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):
请回答下列问题:
(1) A的化学名称是_______;
(2) B和A反应生成C的化学方程式为____ _____________,该反应的类型为_________________;
_____________,该反应的类型为_________________;
(3) D为环壮化合物,不能发生银镜反应,D的结构简式为_________________;F的结构简式为
_________________;
(一)有5种烃:甲烷、乙炔、苯、环己烷、甲苯,分别取一定量的这些烃,完全燃烧后生成m mol CO2和n mol H2O。则
(1)当m=n时,该烃是 ;
(2)当m=2n时,该烃是 ;
(3)当2m=n时,该烃是 ;
(4)当4m=7n时,该烃是 。
(二)有机化学中的反应类型较多,将下列反应归类(填序号)。
①由乙炔制氯乙烯
②乙烷在空气中燃烧
③乙烯使溴的四氯化碳溶液褪色
④乙烯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯
⑥甲烷与氯气在光照的条件下反应
⑦溴乙烷和氢氧化钠乙醇溶液共热
⑧溴乙烷+和氢氧化钠溶液共热
其中属于取代反应的是 ;属于氧化反应的是. ;属于加成反应的是 ;属消去反应的是________;属于聚合反应的是______ 。
Ⅰ.乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式:_________________________________。
(2)已知:
甲醇脱水反应 2CH3OHg) === CH3OCH3g) + H2Og) △H1="=" -23.9 kJ·mol—1
甲醇制烯烃反应 2CH3OHg) === C2H4g) + 2H2Og) △H2="=" -29.1 kJ·mol—1
乙醇异构化反应 C2H5OHg) === CH3OCH3g) △H3== + 50.7 kJ·mol—1[来源:Z_xx_k.Com]
则乙烯气相直接水合反应C2H4g) + H2Og)=== C2H5OHg)的△H == __________________________。与间接水合法相比,气相直接水合法的优点是__________________________________。
Ⅱ. 甲醇虽然毒性很强,但它是一种清洁燃料,也是一种重要的合成原料。工业甲醇的质量分数可以用下列方法测定:
①在稀硫酸中甲醇被Cr2O72-氧化成CO2和H2O,其反应为:
CH3OH + Cr2O72— + 8H+==== CO2↑+ 2Cr3++ 6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应,反应如下所示:
____Cr2O72— + ____Fe2+ +____H+――― ____Cr3++____Fe3+ +____H2O
现有0.12 g工业甲醇,在稀硫酸中与25.0 mL 0.2 mol/L K2Cr2O7溶液反应,多余的K2Cr2O7恰好与9.6 mL 1.0 mol/LFeSO4溶液完全反应。
(3)请配平第②步中离子方程式配平系数依次填写在短线上)。
(4)工业甲醇的质量分数为__________。
试题篮
()