已知使用活性较低的林德拉催化剂[Pd/(PdO、CaCO3)],可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化成烷烃。现有一课外活动兴趣小组利用上述原理设计了一套由如下图所示仪器组装而成的实验装置(铁架台未画出),拟由乙炔制得乙烯,并测定乙炔氢化的转化率。若用含0.02 mol CaC2的电石和1.60 g含杂质18.7 %的锌粒(杂质不与酸反应)分别与足量的X和稀硫酸反应,当反应完全后,假定在标准状况下测得G中收集到的水VmL。试回答有关问题。
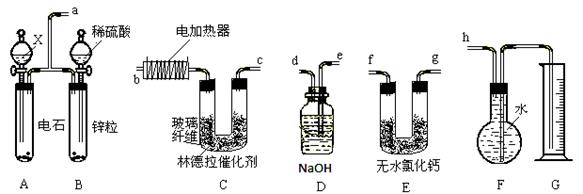
(1)所用装置的连接顺序是 (填各接口的字母)。
(2)写出A、C中所发生的两个反应的化学方程式(有机物写结构简式):
A
C
(3)为减慢A中的反应速率,X应选用__________________。
(4)F中留下的气体除含少许空气外,还有______________________。
(5)若V=672mL(导管内气体体积忽略不计),则乙炔氢化的转化率为___________。
(10分)Ⅰ.实验室制得气体中常含有杂质,影响其性质检验。下图A为除杂装置,B为性质检验装置,完成下列表格: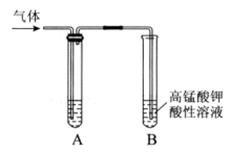
| 序号 |
气体 |
反应原理 |
A中试剂 |
| ① |
乙烯 |
溴乙烷和NaOH的醇溶液加热 |
|
| ② |
乙烯 |
无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是 。 |
NaOH溶液 |
| ③ |
乙炔 |
电石与饱和食盐水反应 |
|
Ⅱ.为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴加热相同时间,观察到如下现象。
| 试管编号 |
① |
② |
③ |
| 实验操作 |
 |
 |
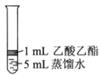 |
| 实验现象 |
酯层变薄 |
酯层消失 |
酯层基本不变 |
(1)试管①中反应的化学方程式是 ;
(2)对比试管①和试管③的实验现象,稀H2SO4的作用是 ;
(3)试用化学平衡移动原理解释试管②中酯层消失的原因 。
(共8分)实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物。某研究性学习小组欲用下图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型。回答下列问题:
(1)写出实验室制备乙烯反应的化学方程式: ,实验中,混合浓硫酸与乙醇的方法是将_____________慢慢加入另一种物质中;加热F装置时必须使液体温度___________(选填缓慢或迅速)升高到170℃,圆底烧瓶中加入几粒碎瓷片的作用是 。
(2)为实现上述实验目的,装置的连接顺序为F→______________→D。(各装置限用一次)
(3)当C中观察到 时,表明单质溴能与乙烯反应;若D中 ,表明C中发生的是取代反应;若D没有出现前面所描述的现象时,表明C中发生的是加成反应。
实验室制乙烯,常常因为温度过高而使乙醇与浓硫酸反应生成少量的二氧化碳,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。

(1)写出实验室制取乙烯的化学方程式________________________________
(2)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中可盛放的试剂是:(将下列有关试剂的序号填入空格内)
Ⅰ: 、Ⅱ: 、Ⅲ: 、Ⅳ: 。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.溴水 |
(3)能说明二氧硫存在的现象是 。
(4)使用装置(Ⅱ)的目的是 。
(5)使用装置(Ⅲ)的目的是 。
(6)确证含乙烯的现象 。
(7)进行下列实验时,都要使用温度计,回答下列问题:
制取乙烯时,温度计水银球部位应放在 。
石油分馏时,温度计水银球部位应放在 。
下图是实验室用来验证乙烯与氢气反应产物的装置,请回答下列问题:
(1)此装置用来制取乙烯,其中包括的仪器是:
①碎瓷片②石棉网和铁架台③圆底烧瓶④温度计(量程 100℃)⑤温度计(量程200℃)⑥酒精灯⑦单孔塞 ⑧双孔塞⑨导管。不选用的仪器有___________ (填其序号)
(2)写出实验室制取乙烯的化学方程式 。
(3)此处碱石灰的作用是 。
(4)实验过程中,发现溴水会褪色,可能的原因是 。
(5)装置中点燃的气体刚开始为,出现什么现象可说明生成了乙烷?
实验室通常用无水乙醇和浓硫酸加热到170℃制取乙烯,反应方程式为:CH3CH2OH CH2=CH2↑+H2O。若温度过高或加热时间过长,制得的乙烯往往混有CO2、SO2、H2O(g)。
CH2=CH2↑+H2O。若温度过高或加热时间过长,制得的乙烯往往混有CO2、SO2、H2O(g)。
(1)试用下图所示的装置设计一个实验(必要的装置可重复使用),验证制得的气体中含有乙烯,二氧化碳,二氧化硫和水蒸气,按气流的方向,各装置的连接顺序是 
(2)实验时若观察到:①中A瓶中溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色,则A瓶的作用是 ,B瓶的作用是 ,C瓶的作用是 。
(3)检查装置④的气密性操作是:
(4)若气体通过装置③中所盛溶液时,产生白色沉淀,它可以用来验证的气体是____。若气体通过装置③中所盛溶液时,溶液的颜色消失,则该溶液的名称是______。
(5)装置②中所加的试剂名称是____ __,它可以验证的气体是__________,简述确定装置②在整套装置中的位置的理由是_______________________________。
(6)某同学做此实验时发现装置④存在的不妥之处是:
化学兴趣小组用下图所示装置进行探究实验。以验证产物中有乙烯生成且乙烯具有不饱和性。
当温度迅速上后,可观察到试管中的溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。(已知:二溴乙烷密度2.18 g·cm-3,不易溶于水,易溶于醇、醚、丙酮等有机溶剂)。
请回答下列问题:
(1)该实验中生成乙烯的化学方程式:_______________________________________。
(2)甲同学认为:该混合液体反应复杂,溴水褪色的现象不能证明反应中有乙烯生成及乙烯具有不饱和性。下列理由中正确的是 __________(填选项)。
A.乙烯与溴水易发生取代反应 B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯 D.浓硫酸氧化乙醇生成乙酸,也会使溴水褪色
(3)乙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加了如下图所示装置。
则A中的试剂应为 ___________ , B中的试剂为____________。
(4)丙同学经过观察后认为:试管中另一现象可证明反应中有乙烯生成,这个现象是:
______________________;为验证这一反应是加成反应而不是取代反应,可用pH试纸来测试反应前后溶液的酸性变化,原理是:_____________________。
(5)处理上述实验后烧瓶中废液,最合理的方法是______________(填选项)。
A.废液经冷却后倒入下水道中 B.废液倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸 D.废液倒入盛有水的塑料桶中,经处理后再倒入下水道
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。其装置如下图所示,试回答下列问题。
(1)图中①、②、③、④装置可盛放的试剂是
①________;②________;③________;④________。(将下列有关试剂的序号填入空格内)
| A.品红溶液 | B.NaOH溶液 |
| C.浓H2SO4 | D.酸性KMnO4溶液 |
(2)能说明二氧化硫气体存在的现象是________________________________。
(3)使用装置②的目的是________________________________。
使用装置③的目的是________________________________。
(4)能说明含有乙烯的现象是________________________________。
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯: CH3CH2OH CH2=CH2↑+H2O,加热一段时间后溶液中有黑色现象出现。过一段时间后,经硫酸酸化的高锰酸钾溶液褪色。经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O。
CH2=CH2↑+H2O,加热一段时间后溶液中有黑色现象出现。过一段时间后,经硫酸酸化的高锰酸钾溶液褪色。经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O。
酸性高锰酸钾溶液褪色,甲同学认为能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为不能证明乙烯被酸性高锰酸钾溶液氧化了。
(1)你认为哪个同学的观点正确? _____ (填“甲”或“乙”),理由是(从下列选项中选)_____
| A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了氧化反应 |
| B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了加成反应 |
| C.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,不能证明通入的气体是纯净物 |
| D.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,只能证明通入的气体一定具有还原性 |
(2)丙同学取(Ⅱ)瓶中少量溶液于试管里,加入盐酸和氯化钡溶液,产生白色沉淀,他认为乙烯中一定混有二氧化硫,你认为他的结论是否可靠? _____ (填“可靠”或“不可靠”);理由是_____________________ 。
(3)丁同学想证明乙烯能否与溴发生反应,于是对上述实验进行了改进,改进的方法是:在装置(Ⅰ)和(Ⅱ)之间增加一个装有足量_____的洗气瓶,且将(Ⅱ)瓶中溶液换成_____ 。发生加成反应的化学方程式为
(14分)为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
(1)写出甲同学实验中两个反应的化学方程式:____________________________________、
____________________________________。
(2)乙同学观察到的黑色物质是__________,刺激性气体是__________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。
原因是(用化学方程表示):__________________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。
①设计装置a的作用是_____________________________________________
②浓溴水的作用是_________________________________________________,
稀溴水的作用是___________________________________________________。
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
(1)实验室制备乙烯的反应方程式是:
(2)I、II、III、IV装置可盛放的试剂是I ;II ;III ;IV 。 (将下列有关试剂的序号填入空格内)。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(3)能说明SO2气体存在的现象是 。
(4)使用装置II的目的是 。
(5)使用装置III的目的是 。
(6)确定含有乙烯的现象是 。
(14分)为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
(1)写出甲同学实验中两个反应的化学方程式:
___________________________、__________________________。
(2)乙同学观察到的黑色物质是_____________,刺激性气体是_____________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):_____________________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。
①设计装置a的作用是____________________
②浓溴水的作用是_______________________,稀溴水的作用是____________________。
为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气 体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,超过170℃后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
⑴写出甲同学实验中两个反应的化学方程式:
、
。
⑵乙同学观察到的黑色物质是 ,刺激性气体是 。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):___________ __________。
⑶丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。
①设计装置a的作用是 。
②浓溴水的作用是 ,
稀溴水的作用是 。
试题篮
()