下列性质与氢键无关的是
| A.NH3的熔、沸点比第ⅤA族其他元素氢化物的熔、沸点高 |
| B.乙酸可以和水以任意比互溶 |
| C.常温下H2O为液态,而H2S为气态 |
| D.水分子高温下也很稳定 |
下列说法正确的是( )
| A.同一主族元素气态氢化物从上到下,其沸点逐渐升高 |
| B.非金属单质中一定存在共价键,离子化合物中可能存在共价键 |
| C.非极性键不可能存在于离子化合物中,由非金属元素组成的化合物中一定不存在离子键 |
| D.含有阴离子的物质一定含有阳离子 |
氮化钠和氢化钙都是离子化合物,与水反应的化学方程式(末配平)如下:Na3N+H2O→NaOH+NH3,CaH2+H2O→Ca(OH) 2+H2。有关它们的叙述正确的是
| A.离子半径的大小:Na+>N3->H- |
| B.它们与水发生的反应均属于氧化还原反应 |
| C.两种化合物均只含离子键,不含共价键 |
| D.两固体混合物溶于足量盐酸中可得到三种盐 |
σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成。则下列分子中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠构建而成的是
| A.H2 | B.Cl2 | C.NaH | D.HF |
下列说法中正确的是
| A.中子数为18的氯原子可表示为18Cl |
B.某金属阳离子的结构示意图为 ,其与Cl-形成的化合物都是离子化合物 ,其与Cl-形成的化合物都是离子化合物 |
C.二硫化碳的电子式为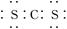 |
| D.17.4g熔融K2SO4与7.8 g熔融Na2O2中阴离子数目相同 |
下列事实与氢键有关的是:
| A.水加热到很高的温度都难以分解 |
| B.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| C.水结成冰体积膨胀,密度变小 |
| D.HF、HCl、HBr、HI的热稳定性依次减弱 |
下列说法正确的是 ( )
| A.Na2O2、NaClO中所含化学键类型完全相同 |
| B.只有活泼金属元素与活泼非金属元素之间才能形成离子键 |
| C.等物质的量的CN-和N2含有的共用电子对数相等 |
| D.氯气与NaOH反应的过程中,同时有离子键、极性键和非极性键的断裂和形成 |
有关乙烯和苯分子中的化学键描述正确的是( )
| A.苯分子中每个碳原子的sp2杂化轨道中的其中一个形成大π键 |
| B.乙烯分子C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键 |
| C.苯分子C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 |
| D.乙烯和苯分子每个碳原子都以sp2杂化轨道形成σ键,未杂化的2p轨道形成π键 |
下列说法正确是( )
| A.含有极性键的分子一定是极性分子 |
| B.单质分子一定是非极性分子 |
| C.氢键一定与氢元素有关 |
| D.共价键只存在于非金属元素之间 |
下列说法错误的是( )
| A. |
糖类化合物也可称为碳水化合物 |
| B. |
维生素D可促进人体对钙的吸收 |
| C. |
蛋白质是仅由碳、氢、氧元素组成的物质 |
| D. |
硒是人体必需的微量元素,但不宜摄入过多 |
膦(PH3)又称为磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,它的分子是三角锥形。以下关于PH3的叙述中,正确的是
| A.PH3是非极性分子 |
| B.PH3分子中有未成键的电子对 |
| C.PH3是强氧化剂 |
| D.PH3分子中的P—H键是非极性键 |
下列物质中含有共价键的离子化合物是
| A.HCl | B.NaOH | C.CaCl2 | D.N2 |
下列分子中所有原子都满足最外层8电子结构的是( )
①CO2 ②XeF6 ③PCl3 ④SO2 ⑤BF3 ⑥N2 ⑦P4 ⑧PCl5
| A.①③⑥⑦ | B.①④⑤ | C.①④⑥ | D.②③④⑤ |
化学式为N2H6SO4的某晶体,其晶体类型与硫酸铵相同,则N2H6SO4晶体中不存在
| A.离子键 | B.共价键 | C.分子间作用力 | D.阳离子 |
试题篮
()