下列说法中正确的是
| A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构 |
| B.P4和CH4都是正四面体形分子且键角都为109°28′ |
C.NH4+的电子式为 ,离子呈平面正方形结构 ,离子呈平面正方形结构 |
| D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 |
氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2―→2HCl +2COCl2。下列说法不正确的有
| A.CHCl3分子的空间构型为正四面体 |
| B.COCl2分子中中心C原子采用sp2杂化 |
| C.COCl2分子中所有原子的最外层电子都满足8电子稳定结构 |
| D.使用前可用硝酸银稀溶液检验氯仿是否变质 |
下列关于离子键的特征的叙述中,正确的是
| A.一种离子对带异性电荷离子的吸引作用与其所处的方向无关,故离子键无方向性 |
| B.因为离子键无方向性,故阴、阳离子的排列是没有规律的、随意的 |
| C.因为氯化钠的化学式是NaCl,故每个Na+周围吸引一个Cl- |
| D.因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子 |
根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是
A.两者都为s sσ键 sσ键 |
B.两者都为p pσ键 pσ键 |
C.前者为p pσ键,后者为s pσ键,后者为s pσ键 pσ键 |
D.前者为s sσ键,后者为s sσ键,后者为s pσ键 pσ键 |
NA表示阿伙加德罗常数的值。下列判断正确的是
| A.常温常压下,17g氨气分子所含质子数为10NA |
| B.1mol Cl2参加反应,转移电子数一定为2NA. |
| C.常温常压下,22.4 L C02分子中含有2NA个σ键和2NA个1π键 |
| D.1 L 0. 01 mol.L-1的Na2CO3溶液中含有0.01NA个CO32- |
下列有关化学用语表示正确的是
A.四氯化碳分子比例模型: |
B.COS的电子式是 |
| C.次氯酸的结构式为H-Cl-O |
D.818O2-离子结构示意图: |
HgCl2的稀溶液可用作手术刀的消毒剂,已知熔融的HgCl2不导电,而HgCl2的稀溶液有弱的导电能力,下列关于HgCl2的叙述正确的是
| A.HgCl2属于离子化合物 |
| B.HgCl2属于共价化合物 |
| C.HgCl2属于非电解质 |
| D.HgCl2是弱酸弱碱盐 |
从实验测得不同物质中氧氧之间的键长和键能的数据:
| O—O键 数据 |
O |
O |
O2 |
O |
| 键长(10-12 m) |
149 |
128 |
121 |
112 |
| 键能(kJ·mol-1) |
x |
y |
z=494 |
w=628 |
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x;该规律性是
A.成键的电子数越多,键能越大
B.键长越长,键能越小
C.成键所用的电子数越少,键能越大
D.成键时电子对越偏移,键能越大
下列说法正确的是
| A.离子化合物中可能含有共价键,但不一定含有金属元素 |
| B.分子中一定含有共价键 |
| C.非极性分子中一定存在非极性键 |
| D.极性分子中一定不存在非极性键 |
共价键是有饱和性和方向性的,下列有关叙述不正确的是
| A.共价键的饱和性是由成键原子的未成对电子数决定的 |
| B.共价键的方向性是由成键原子的轨道的方向性决定的 |
| C.共价键的饱和性决定了分子内部的原子的数量关系 |
| D.共价键的饱和性与原子轨道的重叠程度有关 |
下列分子中所有原子都满足最外层8电子结构的是
①SF6 ②PCl5 ③PCl3 ④CS2 ⑤NO2 ⑥N2
| A.①②④⑤ | B.②③⑤⑥ | C.③④⑥ | D.①③⑤ |
X、Y、Z三种元素的原子,其最外层电子排布为ns1,3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是
| A.X2YZ3 | B.X2YZ2 | C.XYZ2 | D.XYZ3 |
对下列化学用语描述和理解都正确的是
A.原子结构示意图 ,可以表示 ,可以表示 ,也表示 ,也表示 |
B.比例模型 可以表示水分子,也可以表示二氧化碳分子 可以表示水分子,也可以表示二氧化碳分子 |
C.结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
D.电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
下列有关化学用语使用正确的是
A.CH4分子的比例模型: |
B.H2O2的电子式: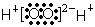 |
C.硫原子的结构示意图: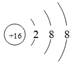 |
| D.醋酸的结构简式:C2H4O2 |
试题篮
()