现有下列物质, 用编号填空回答下列问题:(每空各2分多选错选不得分)
| A.干冰 | B.金刚石 | C.氩 | D.过氧化钠 E.二氧化硅 F. 溴化铵 |
(1)通过非极性键形成的原子晶体是: 。
(2)可由原子直接构成的分子晶体是: 。
(3)含有离子键、共价键、配位键的化合物是: 。
(4)含有非极性键的离子化合物是: 。
已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答
(1)组成A分子的原子的核外电子排布式是 ;
(2)B和C的分子式分别是 和 ;C分子的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的电子式是 ,
该反应的化学方程式为 ;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是 。
(8分)填写下列空白(填序号):
①CH4 ②CH2==CH2 ③CH CH ④NH3 ⑤NH4+⑥BF3 ⑦P4
CH ④NH3 ⑤NH4+⑥BF3 ⑦P4
⑧H2O ⑨H2O2 ⑩ SO2 ⑾PCl3 ⑿SO3 ⒀HCHO ⒁CO2
(1) 呈正四面体的是________。
(2) 属于极性分子且中心原子轨道为sp3杂化的是__________________________,
属于非极性分子且中心原子轨道为sp2杂化的是___________,为sp杂化的是________。
(3) 所有原子共平面的是______________,共线的是______________。
(4) 微粒存在配位键的是________。(5)含有极性键的极性分子是________。
(8分,每空1分))有A、B、C、D、E五种短周期元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号),
原因是_________________________________________________________________
根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
C的单质分子中π键的数目为________,B.D两元素的气态氢化物的稳定性大小关为________>________(填化学式)。
甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃。
(1)甲硅烷中含有的化学键是_________ ,其在固态时属于______晶体。
(2)已知室温下1 g甲硅烷自燃生成SiO2和水放出热量44.6 kJ,则其热化学方程式为_________ 。
用相关的化学用语表示下列物质:
⑴ 写出电子式Al3+ Cl
⑵ 写出下列物质的结构式:N2 CO2
⑶ 用电子式表示NaOH_______________________
下列变化中 ①NaCl 溶于水 ②HCl 溶于水 ③O2 溶于水 ④Na2O2溶于水 ⑤I2升华 ⑥固体NaOH熔化。未发生化学键破坏的是 仅发生离子键破坏的是 ,仅发生共价键破坏的是 既发生离子键破坏,又发生共价键破坏的是 (填序号)。
某些化学键的键能如下表(kJ·mol—1):

(1)根据上表数据判定,H2和Cl2较稳定的是 ;
(2)1 mol H2在足量C12中燃烧,放出热量 kJ。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ;砷与溴的第一电离能较大的是 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ,与其互为等电子体的一种分子为 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为 ,As原子采取 杂化。
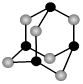
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 个Ga相连,As与Ga之间存在的化学键有 (填字母)。
| A.离子键 | B.σ键 | C.π键 | D.氢键 E.配位键 F.金属键 G.极性键 |
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。D周期序数等于D原子最外层电子数。E原子半径是同周期中最小的(除稀有气体外)根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写),其中D的最高价氧化物是 氧化物。
(2)乙物质中存在的化学键类型是 。
(3)化合物乙的电子式 。
(4)写出C与D的最高价氧化物对应的水化物反应的离子方程式 。
(5)E的单质通入C的最高价氧化物对应的水化物的溶液中反应生成的“84”消毒液的主要成分的化学式为 。
(1)在CaCl2、KOH、CO2、H2SO4、Na2O2、Na2S中含有离子键的是__________,只含共价键的是__________,既含有离子键又含有共价键的是_____________。
(2)书写下列物质的电子式,
NH4Cl________, CO2__________,
推断题科学家们在探索生命奥妙过程中,认识到生命细胞的组成和元素周期律有密切的关系,约占人体质量99.97%的11种大量元素全部位于周期表前20号元素,其余的是十多种人体不可缺少的微量元素。现有a~g 7种短周期元素,是氧、硫、钾、钙外的其它大量元素,它们在元素周期表中的位置如下,并据此回答下列问题:
| a |
|
|
|||||
| |
|
|
d |
e |
|
|
|
| b |
c |
|
|
f |
|
g |
|
(1)元素的原子间最容易形成离子键的是下列中的 (填选项),元素的原子间最容易形成共价键的是下列中的 (填选项)。
A、c和f B、b和g C、d和g D、b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是 (填选项)
A、ea3 B、ag C、fg3 D、dg4
【化学-选修3:物质结构与性质】
(1)I.短周期某主族元素M的电离能情况如图(A)所示,则M元素位于周期表的第____族;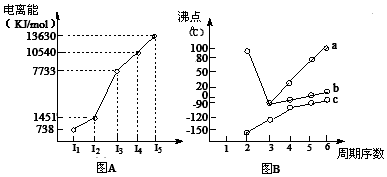
II.图B折线c可以表达出第_________族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:__________(填“a”或“b”);
III.部分有机物的熔沸点见下表: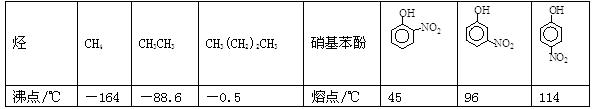
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):____________________;
(2)COCl2俗称光气,分子中C原子采取________杂化成键;其中碳氧原子之间共价键含有______(填字母):
a.2个σ键
b.2个π键
c.1个σ键.1个π键;
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为________________________________;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的2/3,
则绿色晶体配合物的化学式为_________________________。
(1)下列7种固态物质:P4(白磷)、NH4Cl、Ca(OH)2、NaF、CO2、金刚石,回答下列问题(填写化学式或名称):[来源*:%z#zstep.^co&m]
①熔化时不需要破坏化学键的是___ _____,熔化时需要破坏共价键的是_____ ___;
②晶体中既有离子键又有共价键的是_____ ___。
③P4(白磷)、SiO2、NaF、CO2四种晶体熔点由高到低的顺序为_____ ___。
(2)某元素最高正化合价为+6,其最低负价为_____ ___。某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为____ ____。
( 12分)A、B、C、D是四种短周期元素,原子序数依次增大,且只有C为金属元素。A、C位于同一主族,B的最外层电子数为次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等。请回答下列问题:
(1)分别写出A、B、C、D的元素符号 、 、 、 。
(2)D元素位于元素周期表 周期 族,写出实验室制取D单质的化学方程式 。
(3)A、D两种单质形成的化合物存在 (填“共价键”或“离子键”),C、D两种单质形成的化合物存在 (填“共价键”或“离子键”)。
试题篮
()