短周期元素X和Y属于同一主族。负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和60%。
(1)Y位于元素周期表中第___________周期第_______________族;
(2)写出X的质量分数为60%的化合物的化学式__________,该分子中中心原子采取______杂化,分子的空间构型为___________________;
(3)由元素氢、X、Y三种元素形成两种常见化合物的水溶液均呈酸性,试分别写出它们其分子式________、________,并比较它们酸性强弱:________________。
I.元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3 :4,且M原子的质子数是Y原子的2倍;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)写出Y、Z、N按原子个数之比1 :1:1形成的化合物的电子式_______________。
(2)写出由X、Y、Z、M、N中某些原子形成的18电子分子和18电子离子发生氧化还原反应的离子方程式:_________________。

(3)上图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________。
Ⅱ.A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3的型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
(4)D元素在元素周期表中的位置是_____________。
(5)B与D所形成的化合物的化学键类型为______________。
(6)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的离子方程式为_____________。
(7)实验室里除去BA2气体,可用下列试剂中的_____________(填字母)。
A.酸性高锰酸钾溶液 B.浓硫酸
C.NaOH溶液 D.NaHCO3溶液
【原创】(15分)X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为________________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素符号)_________________________。
(3)X、Y、Z三种元素形成盐类化合物的水溶液呈酸性的原因:_________________________。(用离子方程式表示),溶液中所含离子溶液由大到小的顺序为 _。
(4)YX4M的电子式为___ __,Q3Z2与水反应的化学方程式为 。
(5)X、Z两元素能形成的原子个数比为1:1的化合物中含有的化学键为 和 。(填“离子键”或“极性共价键”或“非极性共价键”。)
(6)M的单质与R的最高价氧化物水化物反应的离子方程式为__________________。
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
①D在周期表中的位置是____ ;
②用电子式表示A、B形成化合物的过程:____ ;
③D2C的电子式为 ;
[化学——选修3:物质结构与性质](15分)氮元素可以形成多种化合物。回答以下问题:
(1)①NH3分子的空间构型是_______________;
②化合物NF3为 分子(填“极性”或“非极性”),若其沸点为-129 ℃,则其晶体类型为 。
(2)已知尿素的结构式为: ,
,
①基态氮原子的价电子排布图是_________________。
②其中C、N、O三种元素的电负性由大到小顺序是 。
③尿素分子中C和N原子的杂化方式分别是 、 。
(3)①肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。N2H4分子的电子式为___________。
②肼可用作火箭燃料, 肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在 (填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
|
|
|
|
| |
④ |
|
|
|
|
|
|
|
|
|
|
⑤ |
|
|
⑥ |
⑦ |
|
| |
⑧ |
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
请回答下列问题:
(1)按电子排布,可把周期表中的元素划分成5个区,请在上图中划出区域并注明。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的一种常见溶剂的化学式为 ,其立体构型为__________,键角为______。
(3)某元素原子的价电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为 ;该元素与元素①形成的最简单分子X属于 分子(填“极性”或“非极性”)。
(4)元素④的第一电离能 元素⑤(选填“>”、“=”、“<”)的第一电离能;元素⑥的电负性 元素⑦(选填“>”、“=”、“<”)的电负性。
(5)元素⑥和①形成的化合物的结构式为 ; 元素⑨的基态原子核外电子排布式是 。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式
(本题共12分)氢是宇宙中最丰富的元素,为一切元素之源。
23.H原子的电子排布式是“1s1”,该式子未表明电子运动状态的方面是 (选填编号)。
A.电子层 B.电子亚层
C.电子云的伸展方向 D.电子的自旋
24.金属锂与氢气在一定条件下能直接化合生成 LiH,以下事实能说明LiH是离子化合物的是 (选填编号)。
A.H为-1价 B.熔融状态能导电 C.加热到600℃不分解
LiH的电子式为 。核外有2个电子的简单阴、阳离子有若干种,试比较它们半径的大小 。
25.非金属元素R的气态氢化物的化学式为H8-nR,则R的最高氧化物的化学式为 。
26.根据下表中的键能数据,写出氮气、氢气合成氨气的热化学方程式 。在合成氨的工业生产中,科学家在努力寻找活性温度更低的新催化剂,简述其意义 。
| 共价键 |
键能(KJ/ mol) |
| N≡N |
946 |
| H-H |
436 |
| H-N |
391 |
27.钯(Pd)是优良的储氢金属:2Pd(s)+xH2(g) 2PdHx (s)∆H=-Q(Q>0)
2PdHx (s)∆H=-Q(Q>0)
通常状况下,x的最大值为0.8,为使x>0.8可采取的措施是 ;为使PdHx产生H原子并在固体中快速流动,可采取的措施是 (选填编号)。
A.升温 B.减压 C.及时移走金属钯
(1)下列物质中:互为同素异形体的有 (填序号,下同),属于同位素的有 ,属于同一种物质的有 。
①液氯 ② Cl ③白磷 ④氯气 ⑤红磷 ⑥
Cl ③白磷 ④氯气 ⑤红磷 ⑥ Cl
Cl
(2)下列物质中:只存在共价键的是 (填序号,下同),只存在离子键的是 ,既存在离子键又存在极性共价键的是 ,既存在离子键又存在非极性共价键的是 。
①Ar ②CO2 ③Na2O2 ④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO ⑧H2SO4
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z单质可制成半导体材料,W与X属于同一主族。完成下列有关问题:
(1)元素X的一种核素含10个中子,该核素可表示为________,X的一种氢化物常用来消毒,该氢化物的电子式为________。元素Z在周期表中的位置是________。
(2)元素X和W的简单氢化物中,沸点高的是________(填化学式),理由是________。
(3)请列举两个事实说明元素W的非金属性比Z强: 。
(4)元素X、Y、Z、W形成的二元化合物(指含两种不同元素的化合物)中,化学键的类型相同的一组化合物的化学式是 。
(5)四种元素的原子半径由大到小的顺序是________(填元素符号)。X、Y、W三种元素的原子形成的简单离子中,半径最小的是________(填离子符号)。
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C2- 2与O2+ 2、N2互为等电子体,O2+ 2的电子式可表示为 ;1mol O2+ 2中含有的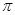 键为 mol。
键为 mol。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 、 。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中有哑铃形的C2- 2存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离相等且最近的C2- 2数目为 。

氮元素可以形成多种分子和离子,如NH3、N2H4、N2-、NH4+、N2H62+等。回答以下问题:
(1)N的基态原子中,有_________个运动状态不同的未成对电子;
(2)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布图是____________;
(3)NH3、N2H4、NH4+、N2H62+四种微粒中,同种微粒间能形成氢键的有_________;不能作为配位体的有_______;
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因是_______;
(5)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①N2H4分子中氮原子的杂化类型是_________;
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)
若该反应中有4mol N-H键断裂,则形成的π键有_________mol;
(6)肼能与硫酸反应生成N2H6SO4.N2H6SO4化合物类型与硫酸铵相同,则N2H6SO4内微粒间作用力不存在_________(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
据2014年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。
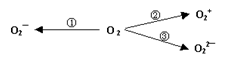
(1)下列有关O4的说法正确的是:
| A.O4分子内存在极性共价键 |
| B.合成O4的反应可看作核聚变反应,即不属于化学变化 |
| C.O4与O3、O2都是氧的同素异形体 |
| D.O4不可用作氧化剂 |
(2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22—的电子式:
(4)O2[PtF6]是一种含有O2+的化合物,请写出一种含有O2-的氧化物的化学式:______________。
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物之间可以反应生盐和水,该反应的离子方程式为__________________________
(2)W与Y可形成化合物W2Y,该化合物的电子式为_________。
(3)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):_________>_________>_________>_________。
(4)Z的最高价氧化物与水反应得到一种稀溶液,写出该反应的离子方程式_________________________
下表是元素周期表中的一部分,根据A~I在元素周期表中的位置,用元素符号或化学式回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|
|
|
|
|
|
|
| 2 |
|
|
|
D |
E |
|
G |
I |
| 3 |
B |
|
C |
|
F |
|
H |
|
(1)上表中,化学性质最不活泼的元素是_____,氧化性最强的单质是_____,还原性最强的是_____。
(2)最高价氧化物对应水化物的碱性最强的元素是________,酸性最强的元素是________。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___________。
(4)请用电子式表示化合物BG的形成过程________________。
(5)写出C的最高价氧化物对应水化物与B的最高价氧化物对应水化物反应的离子方程式:______________。
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍.处于同周期的C、D、E元素中,D是该周期金属元素中金属性最弱的元素.
(1)试比较C、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)
> ;
(2)A、B、C形成的化合物的晶体类型为 ;电子式为 ;
(3)写出D单质与C元素最高价氧化物对应水化物反应的离子方程式 ;
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式 ;
(5)A单质和B单质能构成电池,该电池用多孔惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质,写出该电池负极电极反应方程式 ;
(6)通常条件下, C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6KJ,试写出表示该热量变化的离子方程式 .
试题篮
()