(12分)三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129 ℃,可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备 NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33 ℃)低得多的主要原因是 。
(3)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为 。
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1 ),回答下面各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
①若以上五种元素为前四周期元素,则R为_____________。(填元素符号)
②若五种元素为主族元素,则T为__________区元素。
③若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为 。
已知有五种元素的原子序数的大小顺序为C > A> B> D > E;A和C同周期,B和C同主族;A和B形成离子化合物A2B 中,所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子.试回答下列问题:
(1)写出以下元素的名称: A B E
(2)用电子式表示离子化合物A2B 的形成过程:
(3)写出D元素形成单质的结构式:
(4)写出下列物质的电子式:E与B形成的化合物:
A、B、E形成的化合物:
(5)A和B两元素形成的化合物A2B2中存在的化学键的类型是 。
早期发现的一种天然准晶颗粒由三种、
、
元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过方法区分晶体、准晶体和非晶体。
(2)基态铁原子有个未成对电子,三价铁离子的电子排布式为:可用硫氰化钾奉验三价铁离子,形成配合物的颜色为
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为;一摩尔乙醛分子中含有的键的数目为:。乙酸的沸点明显高于乙醛,其主要原因是:。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数=0.405
,晶胞中铝原子的配位数为。列式表示铝单质的密度
(不必计算出结果)
现有A、B、C、D四种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
(1)B在周期表中的位置 。
(2)写出A的氢化物中原子个数为1:1的物质的电子式: 。
(3)写出CD的溶液与氯气反应的离子方程式 。
(4)比较A、B两种元素形成的简单离子半径的大小(用离子符号表示): 。
(12分)【化学——物质结构与性质】
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,无水合硫酸铜可用作杀菌剂等。
(1)Cu2+的核外电子排布式为________________。
(2)科学家通过X射线测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
①胆矾的化学式用配合物的形式表示为______。
②胆矾中 的空间构型为_________,H2O中O原子的杂化方式为____________。
的空间构型为_________,H2O中O原子的杂化方式为____________。
(3)向硫酸铜溶液中加入过量氨水,可生成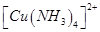 配离子。已知
配离子。已知 的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
(4) N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。
N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。
四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的3倍。
| 甲 |
乙 |
|
| |
丙 |
丁 |
请用化学用语回答:
(1)丙在元素周期表中的位置是 。
(2)丁单质的电子式是 。
(3)乙的两种常见单质分别是 、 。
(4)甲、乙、丙、丁的气态氢化物水溶液显酸性的是 、___________。
(5)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是____________ (填化学式)。此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为 。
(6)电解丙的饱和钠盐溶液的离子方程式为 。
(7)若甲的元素符号为X。已知:①X2(g)+2O2(g)===X2O4(l) ΔH=-19.5 kJ·mol-1;
②X2H4(l)+O2(g)===X2(g)+2H2O(g)ΔH=-534.2 kJ·mol-1。
则液态X2H4和液态X2O4反应生成气态X2和气态H2O的热化学方程式为 。
A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为40,B、W同周期,D、E同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素的盐酸盐或硫酸盐可以用来净水,原理是_______________________(文字表述)。
(2)A2W2的分子中所含的化学键为________、________,经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式___________。
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式____________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种氢化物DA,熔点为800℃,DA能与水反应放氢气,若将1 mol DA和1 mol E单质混合加入足量的水,充分反应后生成气体的体积是__________________(标准状况下)。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1∶2,且无气体生成,则该反应的离子方程式为____________________。
(6)在常温下用气体密度测定BW2的相对分子质量,实验值比理论值偏________(填 “高”或“低”),其原因是___________________。
I.请回答:
(1)CO2的电子式 。
(2)钠燃烧不能用CO2灭火,用化学方程式表示其理由 。
(3)重晶石(BaSO4)不溶于酸,用饱和Na2CO3处理转化为易溶于酸的BaCO3,写出反应的离子方程式 。
(4)完成以下氧化还原反应的离子方程式:
( )Cr2O + ( )H2O2+ _____ =( ) Cr3++ ( ) O2 ↑+ ________
+ ( )H2O2+ _____ =( ) Cr3++ ( ) O2 ↑+ ________
II.化合物K3Fe(A2B4)3·3H2O是重要的催化剂。将化合物K3Fe(A2B4)3·3H2O受热完全分解,只得到气体产物和固体产物。经分析,气体产物只有甲、乙和水蒸气。已知甲、乙均由A、B两元素组成,且摩尔质量:M(甲)<M(乙)。A元素的最外层电子数是次外层电子数2倍,B元素的主族序数是其所在周期数的3倍。经分析,固体产物只有Fe、FeO 和K2AB3。某同学再进行以下定量分析。

(1)甲的化学式: 。
(2)溶液②与KMnO4发生氧化还原的离子方程式: 。
(3)由以上实验数据的分析可知n(Fe):n(FeO) :n(K2AB3) = : : 。
(4)某同学认为:溶液②由紫红色变为无色,振荡试样半分钟内不变色,即可证明溶液②与KMnO4溶液反应到达滴定终点。判断该同学设想的合理性并说明理由 。
按要求填空:有下列物质:①O2;②CO2;③NH3;④Na2O ;⑤Na2O2;⑥NaOH;⑦CaBr2;⑧H2O2;⑨NH4Cl ;⑩HBr,回答下列问题:
(1)只含有极性键的是 ;
(2)只含有非极性键的是 ;
(3)含有极性键和非极性键的是 ;
(4)只含有离子键的离子化合物是 ;
(5)含有非极性键的离子化合物是 。
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C2- 2与O2+ 2、N2互为等电子体,O2+ 2的电子式可表示为 ;1mol O2+ 2中含有的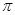 键为 mol。
键为 mol。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 、 。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中有哑铃形的C2- 2存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离相等且最近的C2- 2数目为 。

氮元素可以形成多种分子和离子,如NH3、N2H4、N2-、NH4+、N2H62+等。回答以下问题:
(1)N的基态原子中,有_________个运动状态不同的未成对电子;
(2)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布图是____________;
(3)NH3、N2H4、NH4+、N2H62+四种微粒中,同种微粒间能形成氢键的有_________;不能作为配位体的有_______;
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因是_______;
(5)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①N2H4分子中氮原子的杂化类型是_________;
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)
若该反应中有4mol N-H键断裂,则形成的π键有_________mol;
(6)肼能与硫酸反应生成N2H6SO4.N2H6SO4化合物类型与硫酸铵相同,则N2H6SO4内微粒间作用力不存在_________(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
据2014年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。
(1)下列有关O4的说法正确的是:
| A.O4分子内存在极性共价键 |
| B.合成O4的反应可看作核聚变反应,即不属于化学变化 |
| C.O4与O3、O2都是氧的同素异形体 |
| D.O4不可用作氧化剂 |
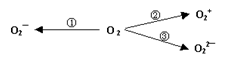
(2)制备含O2-、O22-甚至O2+的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:上述反应中, (填序号)相当于氧分子的氧化; (填序号)相当于氧分子的还原。
(3)写出O22—的电子式:
(4)O2[PtF6]是一种含有O2+的化合物,请写出一种含有O2-的氧化物的化学式:______________。
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物之间可以反应生盐和水,该反应的离子方程式为__________________________
(2)W与Y可形成化合物W2Y,该化合物的电子式为_________。
(3)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):_________>_________>_________>_________。
(4)Z的最高价氧化物与水反应得到一种稀溶液,写出该反应的离子方程式_________________________
下表是元素周期表中的一部分,根据A~I在元素周期表中的位置,用元素符号或化学式回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|
|
|
|
|
|
|
| 2 |
|
|
|
D |
E |
|
G |
I |
| 3 |
B |
|
C |
|
F |
|
H |
|
(1)上表中,化学性质最不活泼的元素是_____,氧化性最强的单质是_____,还原性最强的是_____。
(2)最高价氧化物对应水化物的碱性最强的元素是________,酸性最强的元素是________。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___________。
(4)请用电子式表示化合物BG的形成过程________________。
(5)写出C的最高价氧化物对应水化物与B的最高价氧化物对应水化物反应的离子方程式:______________。
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍.处于同周期的C、D、E元素中,D是该周期金属元素中金属性最弱的元素.
(1)试比较C、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)
> ;
(2)A、B、C形成的化合物的晶体类型为 ;电子式为 ;
(3)写出D单质与C元素最高价氧化物对应水化物反应的离子方程式 ;
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式 ;
(5)A单质和B单质能构成电池,该电池用多孔惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质,写出该电池负极电极反应方程式 ;
(6)通常条件下, C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6KJ,试写出表示该热量变化的离子方程式 .
试题篮
()