有H、C、O、Cl、Na五种元素。
(1)由两种元素组成的四原子离子化合物的电子式__________________,由两种元素组成的三原子共价化合物的电子式______________。(各写1种)
(2)在由三种元素组成的化合物里,其中离子化合物的化学式_____________,共价化合物的化学式______________________。(组成元素不能完全相同)(各写2种)
(1)氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6;氮元素的氢化物除NH3外,还有含2个氮原子的分子的化学式为 ,其沸点比氨气 (填“高”或“低”),该氢化物与足量盐酸反应的化学反应方程式为 。
(2)类似于碳原子,氮原子间也可形成链状结构。某链状结构氮氢化合物中,氮原子间只以N-N单键形式连接形成氢化物。该系列氮氢化合物化学通式为 (n表示氮原子个数)。
(3)生活中广泛使用烃类物质(CmHn)燃料,火箭发射时的高能燃料常用氮氢化合物,比如肼N2H4。2014年10月31日在测试飞行时坠毁的维珍银河公司“太空船2号”商业载人飞船用N2H4燃料,但助燃剂选择不当据说是事故原因之一。经分析该助燃剂分子由氮、氧原子组成,分子中原子最外层电子总数和CO2分子中原子最外层电子总数相同。该助燃剂的化学式为 。上述燃烧反应产物绿色、环保,书写该燃烧反应的化学方程式为 。
(4)分子式为N4的氮元素同素异形体,结构等同于白磷,N4中每个原子满足最外层8e-结构。则1molN4中含有 对共用电子对。已知NH3、-NH2、 、
、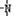 一定条件下都可以和H+结合。则N4和足量的H+反应生成的粒子的化学式为 。化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为 。
一定条件下都可以和H+结合。则N4和足量的H+反应生成的粒子的化学式为 。化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为 。
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1) X在周期表中的位置是__________________________
(2) 化合物Y2X2的电子式为 ;它含有的化学键类型有 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3) A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_____________________________________。
(4) A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正负极电极反应式为_________________________。
(5) 写出化合物Y2X2与水反应的离子方程式_____________________。
(6) B的最高价氧化物的结构式为_______________________________。
(8分,每空1分))有A、B、C、D、E五种短周期元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号),
原因是_________________________________________________________________
根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
C的单质分子中π键的数目为________,B.D两元素的气态氢化物的稳定性大小关为________>________(填化学式)。
金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是.
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是.
(3)过滤金属配合物的中心原子价电子数与配体提供电子总数之和为18,则
.
与
结构相似,
分子内
键与
键个数之比为.
(4)甲醛()在
催化作用下加氢可得甲醇(
).甲醇分子内
原子的杂化方式为,甲醇分子内的
键角(填"大于""等于"或"小于")甲醛分子内的
键角.
有A、B、C、D、E五种元素,它们均为短周期元素。已知A是非金属性最强的元素,且E与A同族;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性。
(1)写出B元素的离子结构示意图 ;C2粒子的符号: ;
(2)B、E两种元素形成化合物的电子式:
(3)A、E两种元素形成的氢化物沸点较高的是: (用化学式表示),其原
因是 。
(4)写出D的气态氢化物与其最高价氧化物的水化物反应的离子方程式
(5)写出D的氢化物(过量)与E的单质发生氧化还原反应生成一种单质和一种盐的化学方程式 。
现有①BaCl2 ②金刚石 ③KOH ④H2SO4 ⑤干冰 ⑥碘片 ⑦晶体硅 ⑧金属铜 八种物质,按下列要求回答:(填序号)
(1)熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的是________,
熔点最高的是________,熔点最低的是________。
(2)属于离子化合物的是________,只有离子键的物质是________,晶体以分子间作用力结合的是________。
(3)请写出③的电子式 ,⑤的电子式 。
(5分)在HF、H2O、NH3、CH4、CO32-、CO2、HI分子中
(1)CO32-的价层电子对的空间构型为
(2)以极性键相结合,具有正四面体结构的非极性分子是 。
(3)以极性键相结合,具有三角锥型结构的极性分子是 。
(4)以极性键相结合,具有V型结构的极性分子是 。
(5)以极性键相结合,而且分子极性最大的是 。
A、B、C、D、E都为短周期元素,A是所有元素中相对原子质量最小的;B的+2价阳离子和C的-1价阴离子都与氖原子具有相同的电子层排布;D在C的下一周期,可与B形成BD2型离子化合物;E和C为同一周期元素,其最高价氧化物的水化物为强酸。
(1)五种元素的元素符号:A 、B 、C 、D 、E 。
(2)B的原子结构示意图为: ;其在周期表中的位置是第 周期,第 主族。
(3)用电子式表示B与C形成化合物的过程:
下表是元素周期表短周期的一部分
| ① |
|
|
||||||
| |
|
|
|
② |
③ |
|
④ |
|
| |
⑤ |
⑥ |
⑦ |
|
|
|
|
(1)①—⑦元素中金属性最强的元素位于周期表第 周期 族。
(2)可作为半导体材料的是 (写元素符号)。
(3)表中元素⑥的原子结构示意图为 。
(4)④与⑤形成的常见化合物的化学键的类型为 ,该化合物的电子式为 。
(5)表中元素①、②、③、⑤、⑦中,原子半径由大到小的顺序是 (填数字序号)
(6)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为 。
氮化钠(Na3N)是科学家制备的一种重要化合物。它与水作用可生成NH3 和一种强碱。回答下列问题:
(1)氮化钠的电子式是 ,该化合物是 化合物(选填“离子”、“共价”)。
(2)氮化钠与水反应的化学方程式是 ,该反应属于 反应。
(3)氮化钠与盐酸反应生成 种盐,其中 (填盐的化学式)既含离子键又含有共价键。
(4)氮化钠中两种微粒的半径大小比较:r(Na+) r(N3-)(填“大于”、“小于”或“等于”)。
有下列物质:①CO2 ②N2 ③H2O2 ④NH3 ⑤Ca(OH)2 ⑥Na2O2 ⑦NH4Cl,试用以上物质的序号填空:
(1)既有极性键,又有非极性键的是______________;
(2)既有离子键,又有非极性键的是______________;
(3)属于共价化合物的是______________。
(7分)现有下列八种物质: HCl、NH4Cl、N2、Na2O2、CaCl2、Cl2、NaF、CO2
回答下列问题:
(1)只含有离子键的物质是 (填化学式,下同)。
(2)既含有离子键,又含有共价键的物质是 。
(3)属于共价化合物的是 ,其中所有原子都满足8电子结构的是 。
(10分)A~F六种元素中,除A外均为短周期元素,它们的原子结构或性质如下表所示:
| 元素 |
原子结构或性质 |
| A |
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| B |
二价阳离子与Ne原子具有相同的电子层结构 |
| C |
形成化合物种类最多的元素,其单质为固体 |
| D |
地壳中含量最多的元素 |
| E |
与D同主族 |
| F |
与E同周期,且最外层电子数等于电子层数 |
(1)A的某种氯化物的浓溶液可用于制作印刷电路铜板,反应的离子方程式为:________________。
(2)CD2分子中化学键的类型是_______________;其与上述某元素形成的物质发生置换反应的化学方程式是______________________。
(3)F的最高价氧化物对应的水化物与E的最高价氧化物对应的水化物反应的离子方程式为_______。
(4)由B、D两种元素形成的化合物的电子式为 。
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1) X在周期表中的位置是__________________________
(2) 化合物Y2X2的电子式为 _________ ;它含有的化学键类型有 _________
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3) A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_____________________________________。
(4) A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为_____________________________________。
(5) 写出化合物Y2X2与水反应的离子方程式_____________________。
(6) B的最高价氧化物的结构式为_______________________________。
试题篮
()