下列叙述错误的是( )
(1)若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
(2)阴、阳离子通过静电吸引形成的化学键叫离子键
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物只能是共价化合物
| A.全部 | B.(1)(2)(3)(4) |
| C.(1)(2)(3)(5) | D.(2)(3)(4) |
下列说法正确的是
| A.离子键就是使阴、阳离子结合成化合物的静电引力 |
| B.所有金属与所有非金属之间都能形成离子键 |
| C.在化合物CaCl2中,两个氯离子之间也存在离子键 |
| D.含有离子键的化合物一定是离子化合物 |
下列说法一定正确的是
| A.其水溶液导电的一定是离子化合物 |
| B.熔融态导电的一定是离子化合物 |
| C.固态导电的一定是金属单质 |
| D.固态不导电但熔融态导电的一定是离子化合物 |
正确掌握化学用语是学好化学的基础,下列有关表述正确的是
A.H、D、T互为同素异形体
B.氨分子中的化学键为非极性共价键
C.NH4Cl的电子式: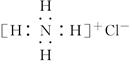
D.S2-的结构示意图: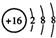
下列变化不能说明发生了化学变化的是( )
| A.变化时有电子的得失或共用电子对的偏移 |
| B.变化过程中有旧化学键的断裂和新化学键的形成 |
| C.变化时释放出能量 |
| D.变化前后原子的种类和数目没有改变,分子种类增加了 |
下列化合物中所有化学键都是共价键的是
| A.Na2O2 | B.NaOH | C.BaCl2 | D.CH4 |
下列现象与氢键有关的是:( )
①H2O的熔、沸点比VIA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④NH3在水中的溶解度很大 ⑤邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的低 ⑥水分子高温下也很稳定:
| A.①②③④⑤⑥ | B.①②③④⑤ | C.①②③④ | D.①②③ |
下列各组中的两种固态物质熔化(或升华)时,克服的微粒间相互作用力属于同种类型的是( )
| A.冰醋酸和硬脂酸甘油酯 | B.金刚石和重晶石 |
| C.碘和碘化钠 | D.干冰和二氧化硅 |
下列各数值表示有关元素的原子序数,其所表示的各原子组中能以共价键相互结合成稳定化合物的是
| A.8与11 | B.9与9 | C.2与19 | D.6与8 |
在下列变化过程中,被破坏的作用力正确的是
| A.干冰升华一一共价键 |
| B.二氧化硅熔融——范德华力 |
| C.氢氧化钠熔融——离子键、共价键 |
| D.硫酸氢钠溶于水——离子键、共价键 |
下列表达方式错误的是
A.氢有三种核素:H、D、T B.S2-的结构示意图:
C.石英中存在SiO2分子 D.CO2分子的结构式:O=C=O
试题篮
()