氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________________________________-。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_________。
有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之_________________________。
(已知Cu2O+2H+==Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能)发生反应产生H2,判断理由是________。
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 ;W的电子式 。
(2)已知:①2E → E-E; =-a kJ·mol-1 ② 2A → A-A;
=-a kJ·mol-1 ② 2A → A-A; =-b kJ·mol-1
=-b kJ·mol-1
③E+A → A-E; =-c kJ·mol-1
=-c kJ·mol-1
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);
X(g); =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 |
甲 |
乙 |
丙 |
| 初始投料 |
2 mol A2、1 mol BC |
1 mol X |
4 mol A2、2 mol BC |
| 平衡时n(X) |
0.5mol |
n2 |
n3 |
| 反应的能量变化 |
放出Q1kJ |
吸收Q2kJ |
放出Q3kJ |
| 体系的压强 |
P1 |
P2 |
P3 |
| 反应物的转化率 |
 1 1 |
 2 2 |
 3 3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率 ( A2)为 。
( A2)为 。
②该温度下此反应的平衡常数K的值为 。
③下列现象能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.内A2、BC、X的物质的量之比为2:1:1
B.内气体的密度保持恒定
C.内A2气体的体积分数保持恒定
D.2 V正(A2)=V逆(BC)
④三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=a C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在上图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
A~E五种元素中,除E外均为短周期元素,且原子序数依次增大。它们的原子
结构或性质如下表所示:
| 元素 |
A |
B |
C |
D |
E |
| 结构或性质 |
原子半径最小的元素 |
地壳中含量最多的元素 |
可与B形成阴阳离子个数比为1:2的两种化合物 |
与B同主族 |
单质是生活中最常见的金属,可被磁铁吸引 |
(1)元素D在周期表中的位置为 。
(2)C与B形成原子个数比为1∶1的化合物中,含有的化学键类型为 。
(3)化合物甲、乙是由A、B、C、D四种元素中的三种组成的强电解质,且两种物质水溶液均显碱性。若甲能抑制水的电离,乙能促进水的电离,则化合物甲的电子式为 ;乙的化学式是 。
(4)以E构成的单质为Y极,碳棒为X极,在6 mol/L的NaOH溶液中进行电解,制取高效净水剂Na2YO4(溶液呈紫红色)。其装置如图。电解过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色,且Y电极变细;电解液澄清。Y极发生的电极反应为:4OH--4e- 2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。
2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。
(5)Se是人体必备的微量元素,与B、D同一主族。Se的原子序数为34,且B、D、Se元素气态单质分别与H2反应生成1 mol气态氢化物的反应热如下:
a.+ 29.7 kJ/mol b.-20.6 kJ/mol c.-241.8 kJ/mol
表示生成1 mol H2Se的反应热是 (填序号);依据是: 。
已知A、B、C、D、E、F六种短周期元素中,A、B、C、D是组成蛋白质的基本元素;A与B的原子序数之和等于C原子核内的质子数;A与E、D与F分别位于同一主族,且F原子核内的质子数是D原子核外电子数的2倍。据此,请回答:
(1)F在周期表中的位置是____________________________。
(2)由A、C、D、F按8:2:4:1原子个数比组成的化合物甲中含有的化学键类型为____________;甲溶液中各离子浓度由大到小的顺序为________________(用离子浓度符号表示)。
(3)化合物乙由A、C组成且相对分子质量为32;化合物丙由A、D组成且分子内电子总数与乙分子内电子总数相等;乙与丙的反应可用于火箭发射(反应产物不污染大气),则该反应的化学方程式为_________________________________________。
(4)由A、D、E、F组成的化合物丁能与硫酸反应并放出刺激性气味的气体,则丁的化学式为________;实验测得丁溶液显弱酸性,由此你能得出的结论是___________________。
(5)由B、A按1:4原子个数比组成的化合物戊与D的常见气态单质及NaOH溶液构成原电池
|
(如图),试分析:

下表为周期表的一部分,其中的编号代表对应的元素。
试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图:________________________________________________________________________。
元素C、D、E、F的第一电离能由大到小的顺序是________(用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有________。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为________。
②该化合物的晶体中存在的作用力有________。
A.离子键 B.极性键
C.非极性键 D.范德华力
E.氢键 F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为________。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是________________________________________________。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是_____________________________________________________________。
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
五种元素原子半径最大是(写元素符号)
X与Z形成的化合物中,既含极性键又含非极性键的是(写分子式)————
由以上某些元素组成的化合物A、B、C、D有如下转化关系

①其中C是溶于水显酸性的气体;D是淡黄色固体。写出C与D反应的化学方程式
②如果A由四种元素组成、B均由三种元素组成,B为两性不溶物,则A为(填名称)
由A与过量C反应转化为B的离子方程式
③如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。则B为(填化学式) 。A、B浓度均为0.1mol/L的混合溶液,碱性较强的是(填溶液名称)
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。
请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是 (填具体离子符号);由A、B、C三种元素按 4:2:3组成的化合物所含的化学键类型属于 。
(2)用某种废弃的金属易拉罐与 A、C、D组成的化合物溶液反应,该反应的离子方程式为: 。
(3)A、C两元素的单质与熔融K2CO3,组成的燃料电池,其负极反应式为 ,
用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LA2时, NaCl溶液的PH= (假设电解过程中溶液的体积不变) 。
(4)可逆反应2EC2(气)+C2(气)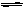 2EC3(气)在两个密闭容器中进行, A容器中有一个可上下移动的活塞, B 容器可保持恒容 (如图所示) ,若在 A 、B 中分别充入lmolC2和2molEC2,使V (A ) =" V" ( B ) ,在相同温度下反应,则:① 达平衡所需时间:t(A ) t ( B )(填>、<、二,或:无法确定,下同)。平衡时 EC2的转化率:a( A ) _a( B )。
2EC3(气)在两个密闭容器中进行, A容器中有一个可上下移动的活塞, B 容器可保持恒容 (如图所示) ,若在 A 、B 中分别充入lmolC2和2molEC2,使V (A ) =" V" ( B ) ,在相同温度下反应,则:① 达平衡所需时间:t(A ) t ( B )(填>、<、二,或:无法确定,下同)。平衡时 EC2的转化率:a( A ) _a( B )。 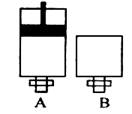
(5)欲比较C和E两元素的非金属性相对强弱,可采取的措施有 (填“序号”)。
a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的单质在常温下的状态
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易
溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入,将其中的氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为
和
,其离子方程式为。
(2)溴与氯能以共价键结合形成。
分子中,显正电性。
与水发生反应的化学方程式为。
(3)分解的热化学方程式为:
在密闭容器中将过量于487
下加热分解,平衡时
为4.66×103
。
①如反应体系的体积不变,提高反应温度,则将会(填"增大"、"不变"或"减小")。
②如反应温度不变,将反应体系的体积增加一倍,则的变化范围为。
下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~ (4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答。
| 族 周期 |
I A |
Ⅱ A |
Ⅲ A |
Ⅳ A |
Ⅴ A |
Ⅵ A |
Ⅶ A |
O |
| 1 |
A |
|
|
|
|
|
|
|
| 2 |
|
|
|
D |
E |
|
G |
I |
| 3 |
B |
|
C |
|
F |
|
H |
|
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 。
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ,
(4)在B、C、E、F、G、H中,原子半径最大的是 ,
(5)A和D组成化合物的电子式 ,
(6)A和E组成化合物的化学式 ,
(7)用电子式表示B和H组成化合物的形成过程 ,
(8)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式
。
试题篮
()