[化学选修—物质结构与性质]
已知A、B、C、D和E 5种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是___________________________;
(2)B和C的分子式分别是__________和__________;C分子的立体结构呈_______形,该分子属于__________分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是 ,该反应的化学方程式是______________________________________________。
(4)若将1 mol E在氧气中完全燃烧,只生成1 mol CO2和2 mol H2O,则E的分子式是_____________。
将下列物质进行分类(填序号)
①O2与O3 ②126C与136C ③白磷与红磷
④冰与水 ⑤H2、D2、T2 ⑥乙醇与二甲醚
⑦ 和
和
(1)互为同位素的是 (2)互为同素异形体的是
(3)互为同分异构体的是 (4)属于同一化合物的是
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息见下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外的三个能级上电子数相等 |
| Y |
Y与X同周期,Y基态原子p能级的成对电子数与未成对电子数相等 |
| Z |
Z的单质是一种银白色活泼金属,在空气中燃烧后生成淡黄色的固体 |
| W |
向含W2+的溶液中滴加强碱,其白色氢氧化物在空气中迅速变成灰绿色,最后变成红褐色 |
(1)W位于周期表的第______周期_____族,其基态原子最外层有________个电子。
(2)X的最简单氯化物分子呈____________型结构, Z在空气中燃烧生成的淡黄色的固体中含有的化学键类型____________________。
(3)若将金属Z投入含WCl3的溶液中,发生反应的离子方程式为____________________。
(4)工业上冶炼W过程涉及以下两个热化学方程式:
3W2Y3(s)+XY(g) =2W3Y4(s)+XY2(g) △H=-15.73kJ/mol
W3Y4(s)+XY (g) =" 3WY" (s)+XY 2(g) △H= +640.4kJ/mol
则反应W2Y3 (s)+XY (g) =" 2" WY (s)+XY 2(g) 的△H= _________________ 。
同族元素所形成的同一类型的化合物,其结构和性质往往相似。化合物 PH4I是一种白色晶体,下列对它的描述中正确的是
| A.它是一种共价化合物 |
| B.在加热时此化合物可以分解为PH3和HI |
| C.这种化合物不能跟碱反应 |
| D.该化合物中只含有共价键 |
X、Y、Z、W、T是原子序数依次增大的前四个周期的元素,其中有两种是金属元素。其相关信息如下表:
| 元素 |
相关信息 |
| X |
X一种核素在考古时常用来坚定一些文物的年代 |
| Y |
Y基态原子的s轨道电子与P轨道电子数相等 |
| Z |
Z是所在周期的单核离子中半径最小 |
| W |
W的单质被誉为“信息革命的催化剂”常用做半导体材料 |
| T |
T有多种化合物,其白色氢氧化物在空气中会迅速变为灰绿色,最后变为红褐色 |
(1)X、Y、Z三种元素的电负性由大到小的顺序是________(用元素符号表示,下同);在H-X、H-Y两种共价键中,键的极性较大的是 。
(2)T2+的电子排布式为_________;T的单质在高温下与Y的氢化物反应,其化学方程式为 ;工业上用W的氧化物与X的单质高温下反应制得W单质的粗产品,其化学反应方程式为
(3)两种氢化物X2H2和H2Y2沸点相差很大,其沸点较高的是_______________,两者沸点相差很大的原因是____________________________________。
(4)在25℃、101 kPa下,已知W稳定的气态氢化物在Y的气态单质中完全燃烧,恢复至原来状态,平均每消耗4gW稳定的气态氢化物放热190.0KJ,则该反应的热化学方程式为 _____________。
下列说法正确的是
①一块冰中氢、氧原子间只以化学键相结合
②金属和非金属化合形成离子键
③离子键是阳离子、阴离子的相互吸引
④双原子单质分子中的共价健一定是非极性键
⑤非金属原子间不可能形成离子键
⑥离子化合物中可能有共价键
⑦共价化合物中可能有离子键
⑧两种不同非金属元素形成的共价化合物中只有极性键
| A.④⑥ | B.②④⑤ | C.①②③ | D.④⑥⑧ |
I.元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3 :4,且M原子的质子数是Y原子的2倍;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)写出Y、Z、N按原子个数之比1 :1:1形成的化合物的电子式_______________。
(2)写出由X、Y、Z、M、N中某些原子形成的18电子分子和18电子离子发生氧化还原反应的离子方程式:_________________。

(3)上图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________。
Ⅱ.A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3的型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
(4)D元素在元素周期表中的位置是_____________。
(5)B与D所形成的化合物的化学键类型为______________。
(6)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的离子方程式为_____________。
(7)实验室里除去BA2气体,可用下列试剂中的_____________(填字母)。
A.酸性高锰酸钾溶液 B.浓硫酸
C.NaOH溶液 D.NaHCO3溶液
元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语。下列有关化学用 语的表示方法中错误的是
A.次氯酸的电子式: |
B.S2-的结构示意图: |
| C.O—18的原子符号:188O |
| D.CO2分子的结构式:O=C=O |
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。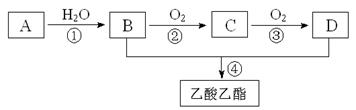
回答下列问题:
(1)写出A的电子式___________。
(2)B、D分子中的官能团名称分别___________、___________。
(3)写出下列反应的反应类型:①___________,②___________,④___________。
(4)写出下列反应的化学方程式:
① 。
② 。
④ 。
下列说法正确的是
①含共价键的化合物一定是共价化合物
②气态单质分子中一定含有共价键
③由非金属元素组成的化合物可能是离子化合物
④离子化合物中一定含有离子键
⑤由不同元素组成的多原子分子里,一定只存在极性共价键
| A.②③ | B.②③⑤ | C.③④ | D.①②④ |
Ⅰ.用 表示原子:
表示原子:
(1)阳离子AXn+中共有x个电子,则该阳离子中含有的中子数目为 。
(2)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为 mol。
Ⅱ.有① 、
、 、
、 ②H2、D2、T2 ③石墨、金刚石 ④
②H2、D2、T2 ③石墨、金刚石 ④ 、
、 、
、 四组微粒或物质。
四组微粒或物质。
回答下列问题:
(1)互为同位素的是 (填编号)。
(2)由①和④中微粒结合形成的水分子种类有 种。
Ⅲ.下列物质中:①N2 ②MgCl2 ③NH4Cl ④CH4 ⑤CO2 ⑥Ne ⑦H2S ⑧KOH ⑨Na2O2 ⑩K2O
只存在共价键的是 ;属于离子化合物,但含有共价键的是 。
四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的三倍。
请用化学用语回答:
(1)丙在元素周期表中的位置___________________________
(2)丁单质的电子式___________________________________
(3)乙的两种常见单质分别是__________,_______________
(4)甲乙丙丁的气态氢化物水溶液显酸性的是(写化学式)________,________
(5)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是(写化学式)__________。此化合物可将碱性工业废水中CN-氧化为可溶性碳酸盐和氨,相应的离子方程式_________________
(6)电解丁的钠盐饱和溶液的离子方程式________________________________
(7)若甲的元素符号为X。已知①X2(g)+2O2(g)==X2O4(l) △H="-19.5KJ/mol" ②X2H4(l)+O2(g)==X2(g)+2H2O(g) △H=-534.2KJ/mol则液态X2H4和液态的X2O4反应生成气态X2和气态H2O的热化学方程式为______________________________________________________
(8分)钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的电子排布式为_____________________;
(2)写出与CO互为等电子体的分子__________________;
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
①TiCl4为______化合物(填“离子”或“共价”)(已知电负性:Ti—1.5,Cl—3.0);
②TiCl4分子为正四面体形,则Ti为________杂化;
③配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 ;
(4)TiCl4在潮湿空气中水解的化学方程式为_____________________________________。
短周期元素X和Y属于同一主族。负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和60%。
(1)Y位于元素周期表中第___________周期第_______________族;
(2)写出X的质量分数为60%的化合物的化学式__________,该分子中中心原子采取______杂化,分子的空间构型为___________________;
(3)由元素氢、X、Y三种元素形成两种常见化合物的水溶液均呈酸性,试分别写出它们其分子式________、________,并比较它们酸性强弱:________________。
试题篮
()