Q、W、X、Y、Z五种短周期元素,原子序数依次增大。Q在元素周期表中原子半径最小,W元素最高正价与最低负价代数和为0;Y与Q同主族;X、Z分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)X、Z简单离子半径较大是 (用离子符号表示)。
(2)由这五种元素中的若干种组成的化合物甲、乙、丙、丁在水溶液中有如下转化关系: ,其中丙是溶于水显酸性的气体,丁是强碱。
,其中丙是溶于水显酸性的气体,丁是强碱。
①若乙常作为焙制糕点的发酵粉,则乙含有的化学键类型有 ;乙溶液中阳离子浓度之和 阴离子浓度之和(填“>”、“=”或“<”)。
②若乙是难溶物,甲溶液与过量的丙生成乙的离子方程式为: 。
W、X、Y、Z是元素周期表中原子前四周期的四种元素,有关它们的信息如下表所示。
| 元素 |
相关信息 |
| W |
W的基态原子L层电子数是K层电子数的3倍 |
| X |
X与氢元素形成的一种化合物可以使湿润的红色石蕊试纸变蓝 |
| Y |
单质为黄绿色气体,最高价氧化物对应的水化物化学式为HYO4 |
| Z |
Z的基态原子外围电子排布式为(n-1)d10ns1 |
(1)Y位于元素周期表第________周期第________族;X的基态原子核外电子排布式是 。
(2)W的简单离子半径 X的简单离子半径(填“>”、“<”或“=”);Y的第一电离能比Z的 (填“大”或“小”);W、X的最简单气态氢化物中,沸点较高的是 (填化学式)。
(3)在150℃左右时,化合物ZW与氢气反应生成红色的Z2W粉末,该反应的化学方程式为 。
(4)W元素形成的多种化合物分子中,含有极性共价键和非极性共价键的分子名称为
(任写一种)。
(5)在25℃、101 kPa下,已知Z固体单质在Y2气体中完全燃烧后恢复至原状态,平均每转移1mol 电子放热110.05kJ,该反应的热化学方程式是 。
A、B、C、D、E为五种原子序数依次增大的短周期主族元素。已知B的最外层电子数与核外电子总数之比为3∶4;D的最外层电子数与次外层电子数之比为3∶4,E-、C+、A+的半径逐渐减小;常温下化合物AE为气体。
请回答下列问题:
(1)D、E的最高价氧化物对应水化物酸性较强的是________(写化学式)。
(2)用惰性电极电解化合物CE的饱和溶液,当电路中有0.2 mol电子通过时两极产生的气体在标准状况下的体积共________ L。
(3)A与B、A与D均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:_______________________________。
(4)化合物乙、丙均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,乙溶液中水的电离程度比纯水的小。则化合物乙中的化学键类型为________;若丙为常见家用消毒剂的主要成分,则丙的化学式是________。
(5)均由A、B、C、D四种元素组成的两种盐发生反应的离子方程式是______________________________________________;其中一种是强酸对应的酸式盐,写出向Ba(OH)2溶液中逐滴加入该盐溶液至中性发生反应的离子方程式:______________________________。
X、Y、Z、W为四种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+3。回答下列问题:
(1)Y-的结构示意图为 。
(2)写出含有10个中子的X原子的原子符号 。
(3)Z的最高价氧化物与Z同主族的单质A能发生置换反应,这个反应在工业上是获得Z的一步重要反应。写出该步反应的化学方程式,并用单线桥法标出电子转移的方向与数目 。
(4)向WY3溶液中加入足量的NaOH溶液,反应的离子方程式为 。
(5)Y的气态氢化物与氨气在空气中相遇有白烟生成,该反应的化学方程式为 。
(6)ZX2中存在的化学键为 (填“离子键”或“共价键”),ZX2与NaOH溶液反应的化学方程式为 。
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________;M在元素周期表中的位置为________;五种元素的原子半径从大到小的顺序是________(用元素符号表示)。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,A的电子式为________,B的结构式为________。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________,该族二~五周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________(填字母代号)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1 c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式:____________________________________;由R生成Q的化学方程式为________________________________________________________。
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y |
地壳中含量最高的元素 |
| Z |
存在质量数为23,中子数为11的核素 |
| W |
生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R |
有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W在元素周期表中的位置为 ;X、Y、Z、W四种元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的结构式为 ;B的电子式为 。化合物ZY中存在的化学键类型为 。
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为 ,其最高价氧化物对应的水化物的化学式为 。该族二、三、四周期元素的气态氢化物的稳定性从大到小的顺序是 (用化学式表示)。
(4)用RCl3溶液腐蚀铜线路板的离子方程式为 。检验溶液中R3+常用的试剂是 ,可以观察到的现象是 。
(5)Z W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
短周期主族元素X、Y、Z、W、M、N 的原子序数依次增大,且原子最外层电子数之和为23。X 的原子半径比Y 的小,X 与W 同主族,Z 的最外层电子数是电子层数的3倍,M 是地壳中含量最高的金属元素。
(1)M的离子结构示意图____________,X、Y形成的含18电子的化合物的电子式____________
用电子式表示由W、Z形成的只含离子键的化合物的形成过程______________________
(2)Y、Z、M原子半径由大到小的顺序____________(用元素符号表示),Z的氢化物稳定性_____N的氢化物稳定性(填“>” “<”或 “=”)
(3)X和Z组成的化合物中,既含有极性共价键又含有非极性共价键的是_________(填化学式),此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨气,相应的离子方程式为:___________________________________________________________。
(4)由以上元素中两种或多种组成的化合物A、B、C、D有下列转化关系:
已知A溶液显碱性,可促进水的电离,用离子方程式表示A溶液显碱性的原因___________________,写出A与D反应的离子方程式______________________________。
现有A、B、C、D、E、F、G七种元素,期中 A、B、C、D、E、F为短周期元素且原子序数依次增大;A的最高正价与最低负代数和为零;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应;D的次外层电子数为最外层的三分之一;E原子半径在同周期中除稀有气体外最大,E与F可形成离子化合物EF,G的合金在生活中用量最大,用途最广。
(1)G在元素周期表中的位置是______________
(2)D、E、F离子半径由大到小顺序为:___________________(用离子符号表示)
(3)A与D形成原子个数比为1:1化合物的电子式为:_________________________
(4)D与E形成某离子化合物具有漂白性,该化合物和B与D形成的某化合物反应的化学方程式为:_______________________,试写出利用该反应原理在生活中的一个用途:_____________
(5)若X为正盐,加热该盐的化学方程式为:____________________________________
(6)用电子式表示EF的形成过程:______________________________________________
(7)B、C、F三种元素最高价氧化物的水化物的酸性由强到弱的顺序为:___________________
磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为 ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空:
(1)磷元素原子核外最外层电子排布式为 。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为 。
(2)氧原子核外有 种不同能量的电子。
(3)写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式 。
(4)磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________。
(5)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________。
(6)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+ →__Ni + ___H2PO3-+ 。请完成并配平上述反应离子方程式。该反应的还原产物是__________。
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
五种元素原子半径最大是(写元素符号)
X与Z形成的化合物中,既含极性键又含非极性键的是(写分子式)————
由以上某些元素组成的化合物A、B、C、D有如下转化关系

①其中C是溶于水显酸性的气体;D是淡黄色固体。写出C与D反应的化学方程式
②如果A由四种元素组成、B均由三种元素组成,B为两性不溶物,则A为(填名称)
由A与过量C反应转化为B的离子方程式
③如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。则B为(填化学式) 。A、B浓度均为0.1mol/L的混合溶液,碱性较强的是(填溶液名称)
(1)下图是部分短周期元素原子半径与原子序数的关系图。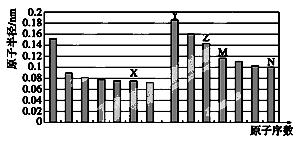
①由X、Y形成的既含离子键又含共价键的物质的电子式:
②实验室制备N单质的离子反应方程式:
(2)CaCO3是一种难溶物质,其Ksp=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.8×10-5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)羟胺(NH2OH) 可看成是氨分子内的l 个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。NH2OH 的水溶液呈弱碱性的原理与NH3的水溶液相似,用电离方程式表示NH2OH 在水溶液中显碱性的原因 。
(4)“甲醇-空气”绿色燃料电池的工作原理示意图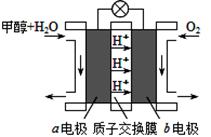
写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
元素 元素性质或原子结构
A 周期表中原子半径最小的元素
B 原子核外有三种不同的能级且各个能级所填充的电子数相同
C 最外层p轨道半充满
D 位于短周期,其原子的核外成对电子数是未成对电子数的3倍
E 位于ds区且原子的最外层电子数与A的相同
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1)B、C、D第一电离能由小到大为______________。
(2)E的二价离子的电子排布式为______________。
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为_______________;1 mol A2B2D4分子中含有σ键数目为____________。
(4)与化合物BD互为等电子体的阴离子化学式为________________(任写一种)。
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是__________________。
(6)BD2在高温高压下所形成晶体的晶胞如图所示。一个该晶胞中含______________个D原子。

A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。
请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是 (填具体离子符号);由A、B、C三种元素按 4:2:3组成的化合物所含的化学键类型属于 。
(2)用某种废弃的金属易拉罐与 A、C、D组成的化合物溶液反应,该反应的离子方程式为: 。
(3)A、C两元素的单质与熔融K2CO3,组成的燃料电池,其负极反应式为 ,
用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LA2时, NaCl溶液的PH= (假设电解过程中溶液的体积不变) 。
(4)可逆反应2EC2(气)+C2(气) 2EC3(气)在两个密闭容器中进行, A容器中有一个可上下移动的活塞, B 容器可保持恒容 (如图所示) ,若在 A 、B 中分别充入lmolC2和2molEC2,使V (A ) =" V" ( B ) ,在相同温度下反应,则:① 达平衡所需时间:t(A ) t ( B )(填>、<、二,或:无法确定,下同)。平衡时 EC2的转化率:a( A ) _a( B )。
2EC3(气)在两个密闭容器中进行, A容器中有一个可上下移动的活塞, B 容器可保持恒容 (如图所示) ,若在 A 、B 中分别充入lmolC2和2molEC2,使V (A ) =" V" ( B ) ,在相同温度下反应,则:① 达平衡所需时间:t(A ) t ( B )(填>、<、二,或:无法确定,下同)。平衡时 EC2的转化率:a( A ) _a( B )。 
(5)欲比较C和E两元素的非金属性相对强弱,可采取的措施有 (填“序号”)。
a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的单质在常温下的状态
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易
【化学—选修3物质结构与性质】
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族。 E、F都是第四周期元素,
E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有
1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 。
(2)E2+离子的价层电子排布图是 ,F原子的电子排布式是 。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的VSEPR模型为 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为 。
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d= g/cm3。(保留两位小数)
I 含碳原子数最少且存在同分异构体的烷烃的分子式是_____,其同分异构体的结构简式是________。
II从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式_______。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:___________,反应类型:_______。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_____________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
III已知乙烯能发生以下转化:
(1)C中含官能团名称_________;
(2)写出反应的化学方程式及反应类型:
B与D反应的化学方程式__________________;反应类型:________。
试题篮
()