将某一元酸HA与NaOH等体积混合,请根据题目要求回答下列问题:
(1)若c(HA)=c(NaOH)=O.lmol/L,测得混合后溶液的pH>7。
①HA是弱电解质,能证明HA是弱电解质的方法是( )。
A测得0. Imol/L HA的pH>l B.测得NaA溶液的pH>7
C.pH=l的HA与盐酸,稀释10倍后,盐酸的pH变化大
D.用足量的锌分别与相同pH、相同体积的盐酸和HA反应,产生氢气一样多
②混合溶液中,关系式一定正确的是( )。
A.c(A-)>c(Na+)c(OH-)>c(H+) B.c(A-)+c(OH-)=c(Na+)+c(H+)
C.c(HA)+c(A-)=0.1mol/L D.C( HA) +c( H+)= c(OH-)
③若HA(足量)+B2一 A一+HB-;H2B(少量)+2C- B2-+2HC: HA+C- A-十HC
则相同pH的①NaA②Na2B③NaHB④NaC的四种溶液,各物质的物质的量浓度从大到小的顺序为
(填序号)。
(2)若c( HA)==c(NaOH)==0.1mol/L,测得混合后溶液的pH=7。
①现将一定浓度的HA稀释10倍后溶液的pH与该浓度的HA和0.1 mol/L NaOH等体积混合后溶液的pH相等,则HA溶液的浓度为 。
②用标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏低的是 。
A.用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
平达喜是常用的中和胃酸的药物,它的化学成分是铝和镁的碱式碳酸盐,其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g。试通过计算推测该碱式盐的化学式。
(4分) 25℃时,①氢氟酸、②醋酸、③次氯酸的电离常数分别是3.5×10-4、1.8×10-5、3.0×10-8。请推测:它们的酸性由强到弱的顺序为______________________(填序号,下同),相同浓度的溶液中,氢离子浓度最大的是__________,电离程度最小的是_______;相同浓度的④氟化钠溶液、⑤醋酸钠溶液、⑥次氯酸钠溶液pH的从大到小顺序:_____________________________。
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
| A.其溶液的pH=13 |
| B.加入少量NaOH,溶液中c(NH4+)减小,Kw减小 |
| C.与AlCl3溶液反应的离子方程式为 Al3++3OH―=Al(OH)3↓ |
| D.滴加0.10 mol·L-1HNO3溶液到pH=7,溶液中离子浓度关系为:c (NO3―) = c(NH4+)> c(H+)=c(OH―) |
将质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g/cm3),用铂作电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,此时溶液中符合下表关系的是( )
| |
NaOH的 质量分数 |
阳极析出 物质的质量/g |
阴极析出物 质的质量/g |
| A |
0.062(6.2%) |
19 |
152 |
| B |
0.062(6.2%) |
152 |
19 |
| C |
0.042(4.2%) |
1.2 |
9.4 |
| D |
0.042(4.2%) |
9.4 |
1.2 |
下列溶液中,各离子浓度的大小顺序正确的是 ( )
| A.10 mL 0.1 mol·L-1盐酸,c(Cl-)>c(OH-)>c(H+) |
B.10 mL 0.1 mol·L-1氨水,c(OH-)>c(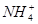 )>c(H+) )>c(H+) |
| C.5 mL 0.2 mol·L-1NaOH溶液,c(Na+)>c(OH-)>c(H+) |
| D.10 mL 0.5 mol·L-1NaOH溶液与6 mL 1 mol·L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与 碱性悬浊液(含有 )混合,反应生成 ,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化, 被 还原为 ,在暗处静置 ,然后用标准 溶液滴定生成的 ( )。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)"氧的固定"中发生反应的化学方程式为_______________。
(3) 溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取 水样经固氧、酸化后,用 溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗 溶液的体积为 ,则水样中溶解氧的含量为_________mg·L − 1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填"高"或"低")
下列实验操作能达到实验目的的是( )
| A. |
用长颈漏斗分离出乙酸与乙醇反应的产物 |
| B. |
用向上排空气法收集铜粉与稀硝酸反应产生的 NO |
| C. |
配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
| D. |
将 与 混合气体通过饱和食盐水可得到纯净的 |
下列有关说法正确的是
A.一定条件下反应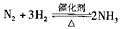 ,达到平衡时, ,达到平衡时,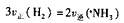 |
| B.10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能减慢反应这率,又不影响H2的生成 |
C.将PH=a十l的氨水稀释为pH=a的过程中,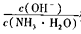 变小 变小 |
| D.常温下,向浓度为0.1 mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7 |
下列叙述正确的是
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B. |
25℃时,等体积等浓度的硝酸与氨水混合后,溶液
|
| C. |
25℃时,0.1
|
| D. |
0.1
|
下列说法正确的是( )
| A.pH=4的溶液中水电离出的H+一定是1×10-4mol/L |
| B.25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH |
| C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D.AgCl沉淀易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl) |
下列说法中,正确的是
| A.25℃时,1L pH=3的盐酸和醋酸能消耗等质量的镁粉 |
| B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)将增大 |
| C.V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2 |
| D.在0.1mol·L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32―离子浓度均增大 |
25℃时,浓度均为0.2 mol/L的NaHCO3溶液中,下列判断不正确的是 ( )
A.存在电离平衡HCO H++CO32— H++CO32— |
B.存在水解平衡HCO+H2O H2CO3+OH- H2CO3+OH- |
| C.将溶液加热蒸干、灼烧得Na2O2固体 |
| D.加入NaOH固体,恢复到原温度,c(OH-)、c(CO32—)均增大 |
试题篮
()