氮是地球上含量丰富的原子元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)25℃时,0.1mol/LNH4NO3溶液中水的电离程度 (填“大于”、“等于”或“小于”) 0.1mol/L NaOH溶液中水的电离程度。
(2)若将0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合,混合溶液中2c(NH4+)>c(NO3-),所得溶液中离子浓度由大到小的顺序是 。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。经测定16g气体在上述反应中放出284kJ的热量。则该反应的热化学方程式是 。
(4)下图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图。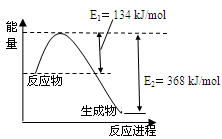
已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
2NO (g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
则反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H是 。
N2(g)+2CO2(g)的△H是 。
下列叙述正确的是
| A.电解精炼铜时,转移1mol电子,阳极上溶解的铜原子数必为0.5NA |
| B.常温下,4.4gCO2和N2O混合物中所含有的原子数为0.3×6.02×1023 |
| C.等体积0.2mol·L-1HCl溶液与0.05mol·L-1Ba(OH)2溶液混合后,溶液的pH=1 |
| D.溶液中由水电离出的c(H+)=1×10-12mol/L,SO42-、NO3-、Fe2+、Mg2+能大量共存 |
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1))重晶石(BaS04)常作胃肠道造影剂。
已知:常温下,Ksp(BaSO4)=1.1×10-10,向BaSO4悬浊液中加入硫酸,当溶液的pH=2时, 溶液中 c(Ba2+)= 。
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H20]常作分析剂。
①检验晶体中含有NH4+的方法为_______。
②等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4)2SO4 d.(NH4)2SO3
其中C(NH4+)由大到小的顺序为 (填选项字母)。
(3)过二硫酸钾(K2S2O8)常作强氧化剂,Na2S2O3常作还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色, 该反应的离子方程式为
②用铂作电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为_____ __电解过程中阴极附近溶液的pH将______ (填“增大”、“减小”或“不变”)
③产品中K2S2O8的含量可用碘量法测定。操作步骤为:称取0.3g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以______为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-=2I-+S4O62-)。重复2次,测得平均消耗标准液21.00mL。该产品中K2S2O8的质量分数为(杂质不参加反应) (列式并计算)。
已知溶液显酸性,溶液中存在以下平衡:

①

②
向0.1溶液中分别加入以下物质,下列有关说法正确的是
| A. |
加入少量金属
|
| B. |
加入少量
|
| C. |
加入少量
|
| D. |
加入氨水至中性,则
|
部分弱酸的电离平衡常数如下表:
| 弱酸 |
|||
| 电离平衡常数 (25 |
下列选项错误的是
| A. |
|
| B. |
|
| C. |
中和等体积、等 |
| D. |
等体积、等浓度的 |
下列有关说法正确的是()
| A. |
反应 |
| B. |
电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| C. |
|
| D. |
|
某二元酸(化学式用H2A)表示,在水中的电离方程式是:
H2A = H+ + HA-, HA- H+ + A2- 回答下列问题:
H+ + A2- 回答下列问题:
(1)Na2A溶液呈 (填”酸性,中性或碱性”),理由是,用离子方程式表示:
.
(2)若0.1 mol•L-1NaHA溶液的pH = 2,则0.1 mol•L-1H2A溶液中氢离子的物质的量浓度可能是___________0.11 mol•L-1(填>、<、=)。理由是_________________________
(3)0.1 mol•L-1NaHA溶液中各种离子浓度由大到小的顺序是______________________
25℃,在20 mL 0.1mol/L 氨水溶液中逐滴加入0.2mol/L HCl溶液(如图),下列说法正确的是
A.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
B.在C点,c<10,且有c(NH4+)=c(Cl—)=c(OH-)=c(H+)
C.若25℃ 0.1mol/L 氨水电离度为1.33%,则b<a<12
D.在D点:2c(NH4+)+2c(NH3·H2O)=c(Cl—)
现有常温下的四份溶液:①pH=2的CH3COOH溶液;②pH=2的稀HCl;③0.01mol/L氨水;
④0.01mol/L NaOH溶液。下列说法正确的是
| A.将四份溶液稀释相同倍数后,溶液的pH:③<④,②<① |
| B.若将②、③等体积混合,则混合液的PH为7 |
| C.四份溶液中水的电离程度由大到小的顺序为:③>①=②=④ |
| D.若在10mL①中加入④至PH刚好等于7,则C(Na+)= C(CHCOO-),混合溶液总体积< 20mL(假设混和溶液体积为酸和碱溶液体积之和) |
下列叙述正确的是( )
| A.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| B.c(H+)=c(OH-)=1×10-6mol/L溶液一定呈中性 |
C.pH=5的H2SO4的溶液稀释500倍以后,溶液中的c(H+):c(SO )=2:1 )=2:1 |
| D.0.1 mol·L-1 CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题: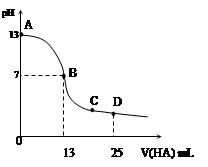
(1)写出MOH在水溶液中的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)__ _____;此时,混合溶液中由水电离出的c(H+)__ _ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)写出B点混合溶液中各离子浓度的大小关系_________ _;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L(数字表达式,不必具体算出结果)
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.1L 1mol/L醋酸溶液中含有的离子总数为2NA |
| B.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
| C.100mL 1mol∙L-1的Na2CO3溶液中CO32-、HCO3-和H2CO3总数为0.1NA |
| D.0.1L 3mol·L-1的FeCl3溶液中含有的Fe3+数目为0.3 NA |
下列溶液中有关物质的量浓度关系不正确的是
A.pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH) < c(NaHCO3) <c(CH3COONa)
B.已知25℃时Ksp (AgCl)=1.8×10-10,则在0.3mol·L-1NaCl溶液中,Ag+的物质的量浓度最大可达到6. 0×10-10mol·L-1
C.25℃时,0.1mol·L-1Na2CO3溶液中水电离出来的c(OH-)大于0.1mol·L-1NaOH溶液中水电离出来的c(OH-)
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有c(HA-) >c(H+)>c(H2A)>c(A2-)
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4] –(aq)+H+(aq)。 下列说法一定正确的是
[B(OH)4] –(aq)+H+(aq)。 下列说法一定正确的是
| 化学式 |
电离常数(298K) |
| 硼酸 |
K=5.7×10-10 |
| 碳酸 |
Ki1=4.4×10-7 Ki2=4.7×10-11 |
| 醋酸 |
K=1.75×10-5 |
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.醋酸滴入碳酸钠溶液中能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较, pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
试题篮
()