某学习小组根据化学知识和下表的数据,设计了表中的实验,以验证酸性:盐酸>碳酸>苯酚>碳酸氢根离子,其中不合理的是 ( )
| 物质 |
电离常数 |
和溶解度(25℃) |
| C6H5OH |
K=1.28×10-10 |
S = 9.3g/100g水 |
| H2CO3 |
K1 =4.3×10-7 |
|
| K2 =5.6×10-11 |
|
| |
组别 |
操作 |
判断依据 |
| A |
盐酸和碳酸 |
往碳酸钙固体中滴加盐酸 |
观察有无气体产生 |
| B |
碳酸与苯酚 |
往苯酚钠饱和溶液中,通入足量CO2 |
观察溶液是否变浑浊 |
| C |
碳酸与苯酚 |
配制同物质的量浓度的碳酸钠溶液和苯酚钠溶液 |
比较溶液的pH |
| D |
HCO3-与苯酚 |
在苯酚悬浊液中,加入过量的 Na2CO3溶液 |
观察悬浊液是否变澄清 |
向20mL 0.5mol/L的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法错误的是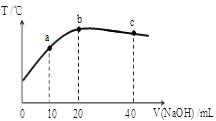
| A.醋酸的电离平衡常数:b点>a点 |
| B.由水电离出的c(OH—):b点>c点 |
| C.从a点到b点,混合溶液中可能存在:c(CH3COO—)= c(Na+) |
| D.b点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO—)>c(OH—)>c(H+) |
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂使反应的△H (填“增大”、“减小”或“不改变”)。
2NH3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂使反应的△H (填“增大”、“减小”或“不改变”)。
(2)在25℃下,向浓度均 为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,沉淀会分步析出。
为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,沉淀会分步析出。
首先生成沉淀的离子方程式为 __________________
氨水过量后,生成的沉淀会部分溶解,写出溶解沉淀的离子方程式__________________________.
( 已知25℃时Ksp[Mg(OH)2]=1.8×10-11, KsP[Cu(OH)2]=2.2×10- 20 )
20 )
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中
c(NH4+) = c(Cl-)。则溶液显 _____ 性(填“酸”、“碱”或“中”),请用含a的代数式表示NH3·H2O的电离常数Kb= 。
(4) 在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO3 0.18mol,则v(o2)= mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,再次达到平衡后, n(SO3)的取值范围为________________。
下列图示与对应的叙述不相符的是
| A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线 |
| B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系 |
C.图3表示压强对可逆反应CO(g)+H2O(g)  CO2(g)+H2(g)的影响,乙的压强比甲的压强大 CO2(g)+H2(g)的影响,乙的压强比甲的压强大 |
| D.图4表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) |
下列说法正确的是
A.常温下,反应4Fe(OH)2(s)+2H2O(1)+O2(g)=4Fe(OH)3(s)能自发进行,则该反应的
B.浑浊的苯酚试液中加入饱和Na2CO3溶液变澄清,则酸性:苯酚>碳酸
C.在等浓度NaCl和NaCrO4稀溶液中滴加AgNO3溶液,分析出AgCl,则KSP(AgCl)<KSP(Ag2CrO4)
D.等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小
下列关于常温下电解质溶液的叙述中,正确的是
| A.碳酸氢按溶液和足量氢氧化钠溶液混合,反应的离子方程式为:HCO- 3+OH-=CO2- 3+H2O |
| B.25℃时,pH=8的0.lmol·L-1NaX溶液中由水电离出的c(OH-)=1×10-8mol·L-1 |
| C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液中,c(NH+ 4)前者小于后者 |
| D.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH+ 4)=c(Cl-)+c(OH-) |
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题 意回答下列问题:
意回答下列问题:
(1)写出酸H2A的电离方程式 。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与2 mol·L-1NaOH溶液等体积混合而得,则溶液M的pH________7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为 。
(3)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为______ ______。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为__________(填“大于”“等于”“小于”或“均有可能”)。
25℃时,弱酸的电离平衡常数如下表:
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| Ka |
1.8×10-5 |
4.9×10-10 |
K1:4.3×10-7 K2:5.6×10-11 |
下列有关说法正确的是( )
A.等物质的量浓度的各溶液的pH关系为: pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol/L HCN与a mol/L NaOH溶液等体积混合后所得溶液呈中性
C.往冰醋酸中逐滴加水稀释,溶液导电能力始终保持减小
D.在Na2CO3溶液中:c(OH-)- c(H+)= c(HCO3-) + 2c(H2CO3)
关于下列各图的叙述正确的是
A.甲中△H1=△H2+△H3
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
下列图示与对应的叙述不相符的是
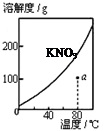
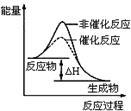
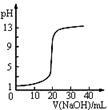
图1 图2 图3 图4
| A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C.图3表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到的滴定曲线 |
| D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
(Ⅰ)室温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 |
HA的物质的量 浓度(mol/L) |
NaOH的物质的 量浓度(mol/L) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? 。
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=________mol/L。
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B===H++HB-HB- H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(III)已知:25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(6)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)_____________。万一误服了少量BaCO3,应尽快用大量0.5 mol/L Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为_____mol/L。
下列关于电解质溶液中离子关系的说法正确的是
| A.0.1mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| B.0.1mol·L-1NH4Cl和0.1mol·L-1NH3·H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-) |
| D.常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存 |
室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合的体积变化)
| |
① |
② |
③ |
④ |
| pH |
12 |
12 |
2 |
2 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH值均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7
常温下,将a mL 三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 |
c(一元酸) |
c(NaOH) /mol/L |
混合溶液的pH |
| 甲 |
c(HX)=0.1 mol/L |
0.1 |
pH = x |
| 乙 |
c(HY)=0.1mol/L |
0.1 |
pH = 7 |
| 丙 |
c(HZ)=0.1 mol/L |
0.1 |
pH = 9 |
(1)上述三种酸中一定属于强酸的是___________;
(2)丙组实验发生反应的离子方程式为 ,所得溶液中由水电离出的c(OH-) = mol/L;
(3)甲组中x的值_____7(填>、<、=);
(4)部分实验反应过程中的pH变化曲线如下图: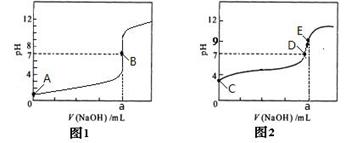
①表示乙组实验的pH变化曲线是________________
②上图中表示溶液呈中性的点为_________,表示溶液恰好完全反应的点是_______
③E点对应离子浓度由大到小的顺序为 。
试题篮
()