在0.1 mol/l的NH3·H2O溶液中,下列关系正确的是
| A.C(NH3·H2O)>C(OH-)>C(NH4+)>C(H+) | B.C(NH4+)>C(NH3·H2O)>C(OH-)>C(H+) |
| C.C(NH3·H2O)>C(NH4+)=C(OH-)>C(H+) | D.C(NH3·H2O)>C(NH4+)>C(H+)>C(OH-) |
下列溶液中的Cl-浓度与50mL 1mol/L MgCl2溶液中的Cl-浓度相等的是 ( )
| A.150 mL 1 mol/L NaCl溶液 | B.75 mL 2 mol/L CaCl2溶液 |
| C.150 mL 2 mol/L KCl溶液 | D.75 mL 1 mol/LAlCl3溶液 |
下列溶液中各微粒的浓度关系或说法正确的是 A.0.1 mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
A.0.1 mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) B.等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>③>④
B.等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>③>④ C.amol·L-1HCN溶液与bmol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.amol·L-1HCN溶液与bmol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b D.0.1mol·L-1的醋酸的pH=a,0.01mol·L-1的醋酸的pH=b,则a+1=b
D.0.1mol·L-1的醋酸的pH=a,0.01mol·L-1的醋酸的pH=b,则a+1=b
常温时将V1mL c1mol·L-1的醋酸溶液滴加到V2 mL c2 moL·L-1的NaOH溶液中下列结论正确的是( )
| A.若混合溶液的pH=7,则c1V1一定等于c2V2 |
| B.若混合溶液的pH<7,则c1V1一定大于c2V2 |
| C.若混合溶液的pH>7,则c1V1一定等于c2V2 |
| D.若混合溶液的pH>7,则c1V1一定小于c2V2 |
将pH=3的盐酸和pH=11的氨水等体积混合,完全反应后,溶液中离子浓度关系正确的是 ( )
| A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B.c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
在0.1mol·L-1 CH3COOH溶液中存在如下电离平衡:
 CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是()
CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是()
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1mol.L-1 HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
0.1 mol/L CH3COONa稀溶液中,下列离子浓度关系不正确的是
| A. c(Na+) + c(H+) = c(CH3COO-)+ c(OH-) |
| B. c(Na+) >c(CH3COO->c (OH-)>c(H+) |
| C. c(CH3COO- )+ c(CH3COOH)=" 0.1" mol/L |
| D. c(Na+)>c(CH3COO--)>c (H+)>c(OH-) |
在200 mL某硫酸盐溶液中,含有1.5 NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为( )
A.2 mol·L-1 B.2.5 mol·L-1 C.5 mol·L-1 D.7.5 mol·L-1
室温下,将1.00mol· L-1盐酸滴入20.00mL1.00mol· L-1氨水中,溶液pH随加入盐
酸体积变化曲线如图所示。下列有关说法正确的是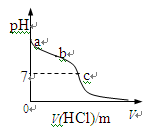
| A.a点:pH=14 |
| B.b点:c(NH4+) +c(NH3·H2O) = c(Cl-) |
| C.c点:水电离出的c(H+) = 1.0×10-7mol· L-1 |
| D.c点后,溶液中离子浓度大小关系一定为: |
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
Mg(ClO3)2在农业上常用作脱叶剂、催熟剂,可采用复分解反应制备:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示。下列叙述正常的是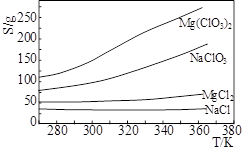
| A.四种化合物的溶解度随温度变化最小的是Mg(ClO3)2 |
| B.300K时,MgCl2的溶解度约为55g |
| C.300K时,100gNaCl饱和溶液中约含有NaCl 36g |
| D.该反应能够进行的条件是生成沉淀,该沉淀是Mg(ClO3)2 |
室温下,向pH=13的氢氧化钡溶液中加入等体积的下列溶液后,滴入石蕊试液,出现蓝色,该溶液可能是:
| A.0.05 mol·L-1的硫酸溶液 |
| B.0.1 mol·L-1的硫酸钠溶液 |
| C.pH=1的醋酸溶液 |
| D.pH=1的盐酸 |
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列结论正确的是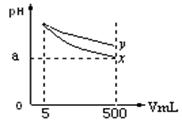
| A.相同温度下,x的电离平衡常数小于y |
| B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液,y的pH大 |
| C.若x、y都是弱碱,则a的值一定大于9 |
| D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) |
向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
| A.减小、增大、减小 | B.增大、减小、减小 |
| C.减小、增大、增大 | D.增大、减小、增大 |
试题篮
()