下列表述中,合理的是
| A.将水加热,Kw增大,pH不变 |
| B.NaHCO3溶液中存在6种分子或离子 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 |
常温下,某溶液中由水电离出的c(H+)与c(OH-)的乘积为10-10,该溶液可能是( )
| A.pH等于5的醋酸溶液 | B.一定浓度的NaOH溶液 |
| C.一定浓度的NaHSO4溶液 | D.一定浓度的NH4Cl溶液 |
某种一元强碱MOH溶液加入一种一元酸HA反应后,溶液呈中性,下列判断一定正确的是
| A.加入的酸过量 | B.生成的盐不水解 |
| C.酸和碱等物质的量混合 | D.反应后溶液中c(A-)=c(M+) |
常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是
| A.硫酸溶液的体积为30 mL |
| B.b时刻溶液中SO42-的浓度约为0.125 mol·L-1 |
| C.d时刻溶液的pH约为13 |
| D.溶液的导电能力:c<d=b<a |
下列溶液中,各离子浓度的大小顺序正确的是 ( )
| A.10 mL 0.1 mol·L-1盐酸,c(Cl-)>c(OH-)>c(H+) |
B.10 mL 0.1 mol·L-1氨水,c(OH-)>c(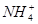 )>c(H+) )>c(H+) |
| C.5 mL 0.2 mol·L-1NaOH溶液,c(Na+)>c(OH-)>c(H+) |
| D.10 mL 0.5 mol·L-1NaOH溶液与6 mL 1 mol·L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
25℃时,浓度均为0.2 mol/L的NaHCO3溶液中,下列判断不正确的是 ( )
A.存在电离平衡HCO H++CO32— H++CO32— |
B.存在水解平衡HCO+H2O H2CO3+OH- H2CO3+OH- |
| C.将溶液加热蒸干、灼烧得Na2O2固体 |
| D.加入NaOH固体,恢复到原温度,c(OH-)、c(CO32—)均增大 |
下列说法正确的是
| A.在纯水中加入醋酸会促进水的电离 |
| B.1 mL pH = 2的醋酸稀释至10 mL,pH=3 |
| C.常温下,0.1 mol·L –1氯化铵溶液加水稀释,溶液中所有离子浓度均减小 |
| D.加热Na2CO3溶液能提高其除油污的能力 |
下列各项中的两个量,其比例2∶1的是
| A.硫酸铵固体中n(NH4+)与n(SO42—) |
| B.相同温度下,0.01 mol/L的醋酸溶液与0.02 mol/L 醋酸溶液中的c(H+) |
| C.液面均在“0”刻度时,50 mL酸式滴定管和25 mL酸式滴定管内所盛溶液的体积 |
| D.40℃时pH=7的(NH4)2SO4与NH3·H2O的混合液中,c(NH4+)与c(SO42—) |
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是( )
| A.c(NH4+):③>① |
| B.水电离出的c(H+):②>① |
C.①和②等体积混合后的溶液:c(H+)=c(OH )+c(NH3·H2O) )+c(NH3·H2O) |
D.①和③等体积混合后的溶液:c(NH4+)>c(Cl )>c(OH )>c(OH )>c(H+) )>c(H+) |
下列有关实验原理、方法和结论都正确的是
| A.用HN02溶液作导电性实验,灯光较暗,说明HN02是弱电解质 |
| B.在滴有酚酞的Na2C03溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2C03溶液中存在水解平衡 |
| C.将等体积、等pH的盐酸和醋酸溶液分别稀释相同倍数,醋酸溶液的pH变化大 |
| D.利用溶解性的不同,可用酒精将碘水中的碘萃取出来 |
下列说法正确的是
A 向饱和食盐水中通入HCl气体,看不到明显的现象
B将硫酸铜溶液与碳酸钠溶液混合,得到的沉淀以Cu(OH)2为主,说明了在相同条件下Cu(OH)2的溶解度比CuCO3的更小
C 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH=7
D.25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw
下表是五种银盐的溶度积常数Ksp(25℃),下列说法不正确的是
| 化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
| 溶度积 |
1.4×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.51×10-16 |
A.25℃时五种银盐的饱和溶液中,c(Ag+)最大的是Ag2SO4溶液
B.在氯化银的悬浊液中加入Na2S溶液可以生成黑色的Ag2S
C.25℃时,在等物质的量浓度的NaCl、CaCl2两溶液中加入足量的AgCl固体形成饱和溶液,则两溶液中AgCl的溶度积相同,且两溶液中c(Ag+)也相同
D.AgBr沉淀可以转化成AgI沉淀,而 AgI沉淀在一定条件下也可以转化成AgBr沉淀
常温下,下列溶液中的微粒浓度关系正确的是
常温下甲、乙两醋酸溶液,测得甲的pH= a,乙的pH= a+1
下列推断中正确的是( )
| A.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍 |
| B.物质的量浓度c(甲)=10c(乙) |
| C.中和等物质的量的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲) |
| D.甲中的c(OH-)为乙中的c(OH-)的10倍 |
试题篮
()