关于下列各图的叙述正确的是
A.甲中△H1=△H2+△H3
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
下列图示与对应的叙述不相符的是
| A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线 |
| B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系 |
C.图3表示压强对可逆反应CO(g)+H2O(g)  CO2(g)+H2(g)的影响,乙的压强比甲的压强大 CO2(g)+H2(g)的影响,乙的压强比甲的压强大 |
| D.图4表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) |
下列图示与对应的叙述不相符的是
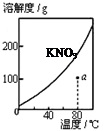
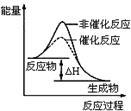
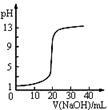
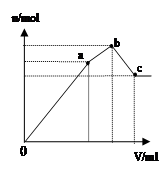
图1 图2 图3 图4
| A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C.图3表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到的滴定曲线 |
| D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
下列说法正确的是( )
| A.室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NAHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.200 0 mol·L-1 NAOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③ |
下列说法正确的是( )
| A.室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.200 0 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③ |
工业上常用还原沉淀法处理含铬废水(Cr2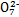 和Cr
和Cr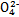 ),其流为:
),其流为:
Cr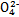
 Cr2
Cr2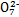
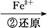 Cr3+
Cr3+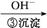 Cr(OH)3↓
Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr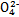 (黄色)+2H+
(黄色)+2H+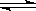 Cr2
Cr2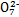 (橙色)+H2O
(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) 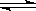 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在
下列有关说法中正确的是
A.步骤①中加酸,将溶液的pH调节至2,溶液显黄色,Cr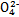 浓度增大 浓度增大 |
B.步骤①中当2v(Cr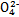 )=v(Cr2 )=v(Cr2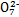 )时,说明反应2Cr )时,说明反应2Cr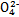 (黄色)+2H+ (黄色)+2H+ Cr2 Cr2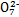 (橙色)+H2O达到平衡状态 (橙色)+H2O达到平衡状态 |
C.步骤②中,若要还原1 mol Cr2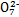 ,需要12 mol (NH4)2Fe(SO4)2·6H2O ,需要12 mol (NH4)2Fe(SO4)2·6H2O |
| D.步骤③中,当将溶液的pH调节至6时,则可认为废水中的铬已除尽 |
下列叙述中正确的是
| A.根据上图,若滴定前仰视读数,滴定终点时俯视读数,则测定的盐酸浓度偏高 |
| B.25℃时,难溶物XY和AB3的KSP分别为1.0×10-10和2.7×10-15,则饱和溶液中C(X+)一定大于C(A3+) |
| C.每个Fe(OH)3胶体粒子含一个氢氧化铁分子 |
| D.某溶液中存在K+、HCO-3、CO2-3、OH-、H+,其离子浓度大小顺序可能为c(K+)>c(HCO-3)>c(H+)>c(CO32-) |
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为。
(2)25℃,在0.10-1
溶液中,通入
气体或加入
固体以调节溶液
,溶液
与
(
-)关系如图(忽略溶液体积的变化、
的挥发)。
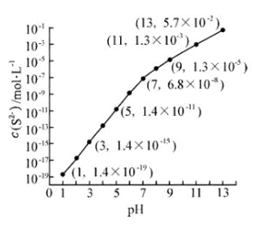
①pH=13时,溶液中的(
)+
(
-)=
-1.
②某溶液含0.020 -1
2+、0.10
-1
,当溶液
= 时,
2+开始沉淀。
[已知:(
)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
| Ka1 |
Ka2 |
|
| H2SO3 |
1.3×10-2 |
6.3×10-4 |
| H2CO3 |
4.2×10-7 |
5.6×10-11 |
①HSO3-的电离平衡常数表达式= 。
②0.10 -1
溶液中离子浓度由大到小的顺序为 。
③溶液和
溶液反应的主要离子方程式为。
下列关于电解质溶液中离子关系的说法正确的是
| A.0.1mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| B.0.1mol·L-1NH4Cl和0.1mol·L-1NH3·H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-) |
| D.常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存 |
下列溶液或浊液中,关于离子浓度的说法正确的是
| A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-) > c(HCO3-),且2c(Na+)=3[c(CO32-)+c(HCO3-)] |
| C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH-) = c(CH3COOH) + 2c(H+) |
| D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
电导率可用于衡量电解质溶液导电能力的大小,且电导率越大溶液的导电能力越强。室温下 ,用0.l00 mol·L-1的NH3· H2O 滴定10 .00mL 浓度均为0 . 100 mol·L-1HCl和CH3COOH的混合液,电导率曲线如图所示。下列说法正确的是
| A.① 溶液中c(H +)为0 . 200 mol·L-1 |
| B.溶液温度高低为① >③ >② |
| C.③ 点后因离子数目减少使电导率略降低 |
| D.③ 点时溶液中有c ( C1一)>(CH3 COO一) |
(届江西省八校高三下学期联考理综化学试卷)
下列叙述或表示正确的是
| A.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1=b |
| B.常温下0.1 mol·L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)="0.1" mol·L-1 |
| C.难溶电解质AB2的饱和溶液中,c(A2+)=xmol·L-1, c(B-)="y" mol·L-1,则Ksp值为4xy2 |
| D.用200mL4 mol·L-1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O |
(届山东省日照市高三3月模拟考试理综化学试卷)
25oC时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是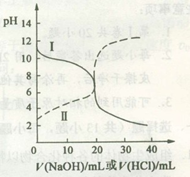
| A.曲线I中滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线I中滴加溶液到25 mL时:c(NH4+)>c(C1-)>c(H+)>c(OH-) |
| C.曲线II中滴加溶液在10 mL~25 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D.曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
某碱性溶液中只含有Na+、CH3COO-、H+、OH- 4种离子。下列描述正确的是( )。
| A.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| B.该溶液一定由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成 |
| C.该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.加入一定量冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+) |
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;
则有:Ka·Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变 。
| A.①④ | B.①②④ | C.①②④⑤ | D.①②③④ |
试题篮
()