室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目增加,导电性增强 |
| B.醋酸的电离程度增大,c(H+)亦增大 |
| C.再加入10mL pH="11" NaOH溶液,混合液pH=7 |
D.溶液中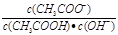 不变 不变 |
将一元碱BOH的溶液与一元酸HA的溶液等体积混合,若所得溶液呈碱性,下列有关判断正确的是
| A.若混合前酸、碱pH之和等于14,则HA肯定是弱酸 |
| B.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸 |
| C.溶液中水的电离程度:混合溶液>纯水>BOH溶液 |
| D.混合溶液中离子浓度一定满足:c(B+)>c(A—)>c(H+)>c(OH—) |
下列叙述错误的是
| A.从FeCl3固体出发配制其溶液时,应先将FeCl3固体溶解在一定浓度的盐酸溶液中,然后再稀释到所需要的浓度 |
B.Al3+的水解方程式为 Al3+ + 3H2O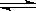 Al(OH)3 + 3H+ Al(OH)3 + 3H+ |
| C.NaHSO4在水溶液中的电离方程式为 NaHSO4 =" Na+" + H+ + SO42- |
| D.H2CO3的电离方程式为 H2CO3 =" H+" + HCO3- |
用惰性电极电解下列溶液一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),可能使溶液完全复原的是
| A.CuCl2 (CuO) | B.NaOH (NaOH) |
| C.CuSO4 (Cu(OH)2 ) | D.NaCl (Cl2) |
(7分)用电石和水反应,产生的乙炔中含有H2S等杂质。某学生拟选用①NaOH溶液、②KMnO4溶液、③CuSO4溶液、④浓HNO3、⑤浓H2SO4中的一种除去H2S杂质,经研究最后他确定选用的溶液是 (填序号),如果没有该试剂,请你用其它试剂代替(写一种化学式) 。选用前者而发生的离子方程式为 。但这一方程式所表示的制取原理与一般的情况有所不同,如强制弱、稳定制不稳定、难挥发制易挥发等,请用离子方程式表述将稀盐酸逐滴滴加到NaOH和Na2CO3混合溶液中的变化过程: 。
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)= 0时,c(H+)="1" × 10-2 mol/L |
| B.V(NaOH)< 10 mL时,不可能存在c(Na+)=" 2" c(C2O42-)+ c(HC2O4-) |
| C.V(NaOH)=" 10" mL时,c(H+)="1" × 10-7mol/L |
| D.V(NaOH)> 10 mL时,c(Na+)> c(C2O42-)>c(HC2O4-) |
下列有关的叙述正确的是
| A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为 c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb |
| D.Na2BeO2溶液的pH>7,BeCl2溶液的pH<7,分别将它们蒸干并灼烧后,都可能生成BeO |
如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是 
| A.Cu极附近OH-浓度增大 |
| B.Cu极为原电池负极 |
| C.电子流向是由C极流向Pt极 |
| D.当C极上有4 mol电子转移时,Pt极上有1 mol O2生成 |
室温下,下列叙述正确的是(溶液体积变化忽略不计) ( )
| |
① |
② |
③ |
④ |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
| pH |
11 |
11 |
3 |
3 |
A.分别将等体积的③和④加水稀释100倍,所得溶液的pH:③<④
B.在①、②中分别加入氯化铵固体,两溶液的pH均增大
C.①、④两溶液等体积混合,所得溶液中c(C1-)> c (NH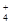 )> c (OH一)> c (H+)
)> c (OH一)> c (H+)
D.②、③两溶液混合,若所得溶液的pH=7,则c (CH3COO一)> c (Na+)
浓度都是0.1 mol·L-1的弱酸HX溶液与NaX溶液等体积混合后,在所得溶液中,有关离子浓度的关系错误的是( )
| A.C(Na+)+C(H+)=C(X-)+C(OH-) |
| B.C(X-)+ C(HX)=2C(Na+) |
| C.若混合物呈酸性, 则C(X-)>C(Na+)>C(HX)>C(H+)>C(OH-) |
| D.若混合物呈碱性, 则C(Na+)>C(HX)>C(X-)>C(OH-)>C(H+) |
已知下面三个数据:7.2×10-4 mol·L-1、4.6×10-4 mol·L-1、4.9×10-10 mol·L-1分别是下列有关的三种酸的电离常数的数值,若已知下列反应可以发生:
NaCN+HNO2===HCN+NaNO2 NaCN+HF===HCN+NaF
NaNO2+HF===HNO2+NaF,由此可判断下列叙述不正确的是
| A.NaCN和HCN 物质的量比1︰1组成的混合溶液呈酸性 |
| B.物质的量浓度均为0.1mol·l-1的NaF、NaNO2、NaCN溶液的pH逐渐增大 |
| C.根据上述某两个反应即可得出电离常数大小的结论 |
| D.电离常数为:K(HCN)<K(HNO2)<K(HF) |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B.0.1 mol·L-1NH4Cl溶液:c(NH4+)=c(Cl-) |
| C.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液c(Na+)=c(NO3-) |
下列溶液中微粒浓度关系一定正确的是 ( )
| A.将水加热到120℃,pH=6:c(OH—)< c(H+) |
| B.醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO—)> c(Na+) |
| C.0.lmoI·L-1的硫酸铵溶液中:c(NH+4)> c(SO2-4)> c(H+) |
| D.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH—)= c(H+) |
试题篮
()