向15mL 0.1mol·L-1KOH溶液中逐滴加入0.2 mol·L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确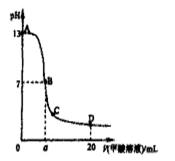
A.在A、B间任意一点c(K+) > c(HCOO-) > c(OH-) > c(H+)
B.在B点:c(K+) = c(HCOO-) > c(OH-) = c(H+),且a=7.5
C.在C点:c(HCOO-) > c(K+) > c(OH-) > c(H+)
D.在D点:c(HCOO-) + c(HCOOH) > 2c(K+)
(8分)A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合.要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。
(1)写出化学式A1________,A2________,B1________,B2________;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为_______________________ _;
(3)写出0.1  的
的 溶液中离子浓度大小排序 ________________;
溶液中离子浓度大小排序 ________________;
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是 ________________;
(5)若B1、B2两溶液的pH=5,则两溶液中水电离出的氢离子的物质的量浓度之比为__________。
25℃时,电离平衡常数:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 1.8×10-5 K1 4.3×10-7 3.0×10-8
K2 5.6×10-11
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,bNaClO,c.CH3COONa
d.NaHCO3;PH由大到小的顺序是:_______________________;(填编号)
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是:____________________;
| A.c(H+) | B.c(H+)/c(CH3COOH) | C.c(H+)·c(OH-) | D.c(OH-)/(H+) |
(3)体积为10mLPH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程PH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是_____________________________________________________________________,稀释后,HX溶液中水电离出来的c(H+)______醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:_______________________________________________________;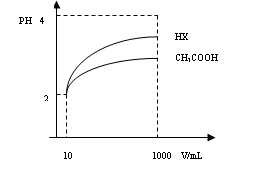
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液PH=6,则溶液中
c(CH3COO-)-c(Na+)=_______________________。(填准确数值)
研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题。
(1)CO可用于合成甲醇。在压强为0.1Mpa条件下,在体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图: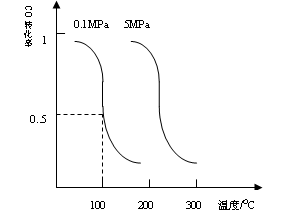
(i)该反应属于_____________反应:(填“吸热”或“放热”)。
(ii)100℃时,该反应的平衡常数:K=_____________;(用a、b的代数式表示)。
若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是:_________________填序号)
| A.该反应使用催化剂意义不大; |
| B.该反应发生将在很短时间内完成; |
| C.该反应达到平衡时至少有一种反应物百分含量很小; |
| D.该反应一定是放热反应; |
(iii)在温度和容积不变的情况下,再向平衡体系中充入amolCO,2amolH2,达到平衡时CO转化率________(填“增大”,“不变”或“减小”,下同)平衡常数:________。
(iv)在某温度下,向一容积不变的密闭容器中充入2.5molCO,7.5molH2,反应生成CH3OH(g),达到平衡时,CO转化率为90%,此时容器内压强为开始时的压强__________倍。
(2)某温度条件下,若将CO2(g)和H2(g)以体积比1:4混合,在适当压强和催化剂作用下可制得甲烷,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol
H2(g)+1/2O2(g)= H2O(l) △H=-285.8KJ/mol
则CO2(g)和H2(g)反应生成液态水的热化学方程式为:_________________________。
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A.0.1mol/L的(CH3COO)2Ba溶液中:C(Ba2+)+C(H+)=2C(CH3COO-)+C(OH-) |
| B.常温下,向醋酸钠溶液中滴加稀盐酸,至溶液呈中性;则混合液中: C(Cl-)﹥C(Na+)﹥C(CH3COOH) |
| C.相同条件下,物质的量浓度相同的①氯化铵溶液;②醋酸溶液;③稀盐酸;溶液中由水电离出来的C(H+):①﹥③﹥② |
| D.PH相等的:①NH4HSO4溶液;②NH4Cl溶液;③(NH4)2SO4溶液,溶液中 |
C(NH4+):②=③﹥①
向0.1mol/L的NaOH溶液中慢慢滴加同浓度的醋酸溶液,离子浓度之间的关系不可能出
现的是
| A.c(CH3COO-)>c(H+) = c(Na+)>c(OH-) | B.c(Na+)>c(OH-) >c(CH3COO-)>c(H+) |
| C.c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | D.c(Na+) >c(CH3COO-)>c(OH-) >c(H+) |
(1)下列溶液中,c(H+)由小到大的排列顺序是
①0.1mol/L HCl溶液 ②0.1mol/L H2SO4溶液
③0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(2)25℃,柠檬水的pH是3,其中c(OH?)= 。
(3)25 ℃,有pH=12的氢氧化钠溶液100ml,要使它的pH降为11。应加蒸馏水的体积为 ml;若加pH=10的氢氧化钠溶液,应加 ml。
(4)25 ℃,pH=3盐酸和pH=11氨水等体积混合后溶液呈 性。(选填“酸”、“中”或“碱”)
(1)25℃,柠檬水的pH是3,其中c(OH-)==
(2)下列溶液中,c(H+)由小到大的排列顺序是
① 0.1mol/L HCl 溶液 ② 0.1mol/L H2SO4溶液
③ 0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(3)在25℃时,1mol· L-1的①(NH4)2SO4 ②CH3COONH4 ③(NH4)2Fe(SO4)2 ④NH4Cl的溶液中,c(NH4+)由大到小的顺序为
(4)pH=3盐酸和pH=11氨水等体积混合后溶液呈 性(选填“酸”、“中”或“碱”),溶液中c(NH4+) c(Cl-)(选填“ >”“=”“<” )。
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答:
(1)写出醋酸的电离方程式_______________________________________。
(2)a、b、c三点溶液中氢离子浓度由小到大的顺序为________________ 。
(3)a、b、c三点中醋酸的电离程度最大的是 。
(4)取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲__ 10C(H+)乙(填“大于”、“小于”或 “等于”)甲,其原因是: 。
(4分)已知25 ℃时,0.1 mol/L醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大,对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的____________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4 | C.气体NH3 | D.固体NaHCO3 |
(2)若乙的解释正确,溶液的pH应__________(填“增大”“减小”或“不变”)。(已知25 ℃时,NH3·H2O的Kb=1.8×10-5,CH3COOH的Ka=1.8×10-5)
(1)25℃,柠檬水的pH是3,其中c(OH-)==
(2)下列溶液中,c(H+)由小到大的排列顺序是
① 0.1mol/L HCl 溶液 ② 0.1mol/L H2SO4溶液
③ 0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(3)在25℃时,1mol· L-1的①(NH4)2SO4 ②CH3COONH4 ③(NH4)2Fe(SO4)2 ④NH4Cl⑤(NH4)2CO3的溶液中,c(NH4+)由大到小的顺序为
(4)pH=3盐酸和pH=11氨水等体积混合后溶液呈 性(选填“酸”、“中”或“碱”),溶液中
c(NH4+) c(Cl-)(选填“ >”“=”“<” )。
将足量的CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2的体积(已经折算成标准状况)的变化曲线如图所示(不考虑过量的CO2在水中的溶解和反应过程中溶液体积的变化),则下列说法不正确的是( )
| A.NaOH溶液的物质的量浓度为0.1mol/L |
| B.NaOH溶液的体积为2L |
| C.M点离子浓度的大小关系满足c(HCO3-)>c(CO32-) |
| D.M、N点对应的纵坐标均大于7 |
下列说法正确的是( )
| A.pH=2与pH=1的硝酸中c(H+)之比为1:10 |
| B.Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1 |
| C.0.2 mol?L-1与0.1mol/L醋酸中c (H+)之比为2:1 |
| D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1 |
在CH3COOH H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
| A.加入NaOH | B.加入盐酸 |
| C.加水 | D.升高温度 |
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_____________________________________________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与2 mol·L-1NaOH溶液等体积混合而得,则溶液M的pH________7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为_____________________________________________。
已知Ksp(BaA)=1.8×10-10,向该混合溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为__________ mol·L-1。
(3)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为____________。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为____(填“大于”“等于”“小于”或“均有可能”)。
试题篮
()