汽车的发明与使用,是人类智慧的杰出体现,它为人们的生活和生产带来了极大的方便,同时由此引发的环境污染问题也越来越引起人们的关注。
(1)汽车排放的尾气中因含有氮的氧化物而污染大气,造成产生氮的氧化物的主要原因是( )
A.燃烧含氮化合物燃料引起的
B.燃烧含铅汽油引起的
C.是由于汽油燃烧不充分引起的
D.是汽缸中的N2被氧化生成的
(2)下列有关城市各项污染源与其造成的恶果对应关系正确的是( )
A.汽车尾气—光化学烟雾;工业废气—酸雨;工业废水—“公害病”
B.汽车尾气—酸雨;工业废气—“公害病”;工业废水—光化学烟雾
C.汽车尾气—“公害病”;工业废气—酸雨;工业废水—光化学烟雾
D.汽车尾气—光化学烟雾;工业废气—“公害病”;工业废水—酸雨
(3)一氧化氮和一氧化碳都是汽车尾气里的有害物质,它们能缓慢地发生如下反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0。现利用此反应,拟设计一种环保装置以消除汽车尾气对大气的污染。下列设计方案可以提高尾气处理效果的是________。
①选用适当的催化剂 ②提高装置的温度 ③降低装置的压强 ④在装置中装入碱石灰
A.①③ B.②④
C.①④ D.②③
(4)新型环保出租车采用LPG+汽油的双燃料系统,其尾气中的有毒气体成分较普通车型下降80%左右,缓解了汽车尾气排放给城市环境造成的污染问题。下列物质中不属于上述有害气体的是________。
A.CO2和H2 B.NO2和NO
C.CO和SO2 D.C粒和含铅化合物
(5)所谓“绿色汽车”是指使用液化石油气等无污染或污染较小的能源作燃料的汽车。绿色汽车可避免有毒的铅、苯的同系物以及稠环芳烃的排放。燃烧等质量的液化石油气(主要成分是含C3~C4的烃)与汽油相比较________。
A.前者生成的水少
B.前者消耗氧气量少
C.前者燃烧产生的热量多
D.前者产生的含碳化合物种类少
(6)为了减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类:一类是压缩天然气,另一类是液化石油气。这两类燃料的主要成分都是________。
A.碳水化合物 B.碳氢化合物
C.氢气 D.醇类
Fe(OH)3胶体在生活中有重要应用,利用FeCl3和沸水反应制备的Fe(OH)3胶体中常混有FeCl3和HCl。已知胶体不能透过半透膜,而小分子和离子可以透过半透膜。试回答下列有关问题:
(1)实验室制取Fe(OH)3胶体的方法是________,用________方法除去胶体中的浑浊物;根据________现象证明胶体已经制成。
(2)检验溶液中存在Fe3+和H+的方法是__________________________________________
(3)除去胶体中混有的FeCl3和HCl的方法是:_________________________________。
(4)如何用实验的方法证明胶体和Cl-已经分离?___________________________。
(5)鉴别Fe(OH)3胶体和FeCl3溶液最简单的方法是_________________________________。
(6)高铁酸钠(Na2FeO4)的氧化性比KMnO4更强,它是一种备受关注的新型净水剂,请指出Na2FeO4净水的原理,并说明该净水剂有何优越性_______________________________________。
对物质净化对生产生活有很重要的意义。
(1)除去水中的Ca2+、Mg2+等阳离子,完成此目标可使用________(填材料名称)。
(2)催化还原法可以净化硝酸工业尾气,下列物质中不能用于除去尾气中氮氧化物的是________。
| A.NH3 | B.CH4 | C.CO2 | D.H2 |
(3)接触法制硫酸的工艺中,沸腾炉产生的炉气必须经过净化,除去其中的粉尘和________,净化后的炉气进入________(填设备名称)。
(4)煤的气化技术的主要产物是________,将煤加工以得到焦炉气、煤焦油及焦炭等产品的技术称为________。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
请回答下列问题:
(1)该反应的热化学方程式为_______________________________________________。
(2)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与双氧水反应生成液态水时放出的热量是________ kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________________________________________________________________。
某自来水厂利用河水处理成自来水的工艺流程示意图如下图所示:
提供的试剂:饱和Na2CO3溶液、NaOH溶液、生石灰、CCl4、BaCl2溶液、KOH溶液
(1)为除去水中含有的Ca2+、Mg2+、HCO3-、Cl-、SO42-,试剂a代表两种化学物质,主要是除去水中SO42-、Mg2+和HCO3-,这两种试剂是________和________(只填化学式)。
(2)凝聚剂A常用FeSO4·7H2O,最终生成红褐色胶体沉淀,该胶状沉淀的化学式为________,可以除去其中的悬浮固体颗粒,该过程是________(填序号)。
A.只有物理变化,无化学变化
B.只有化学变化,无物理变化
C.既有化学变化,又有物理变化
(3)通入CO2的目的是__________和__________。
(4)传统的氧化剂是Cl2,现代工艺用ClO2取代Cl2,通入ClO2的作用是________________________;优点是________________________________。
(5)离子交换柱X、Y中有一种是H+型交换柱,另一种是OH-型离子交换柱,目的是除去水中残留的杂质离子,则X应是哪种交换柱?________(填“H+型”或“OH-型”);如果两个交换柱位置颠倒会产生什么后果?_______________________________________
________________________________________________________________________。
水处理技术在生产、生活中应用广泛。
(1)工业上常用绿矾作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加入绿矾。请解释这一做法的原因:_______________________________________________________________________。
(用必要的离子方程式和文字做答)
(2)根据水中Ca2+、Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。①硬水软化的方法通常有________、________和离子交换法。离子交换树脂使用一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树脂置于________中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比,________洗涤效果较好,原因是________________________________________________________________________。
(3)我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是________________________________________。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理。首先在硝化细菌作用下将NH4+氧化为NO3-:________NH4++________O2=________NO3-+________H++______H2O,然后,加入甲醇与NO3-生成N2:______NO3-+______CH3OH=________N2↑+________CO2↑+________H2O+________OH-。
试配平以上两个离子方程式。
(1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用如图所示的工艺流程生产硫酸。
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装 (填设备名称)。吸收塔中填充有许多瓷管,其作用是 。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 。(空气中氧气的体积分数按0.2计),该尾气的处理方法是 _。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是 (可多选)。
A.耗氧量减少
B.二氧化硫的转化率提高
C.产生的废气减少
D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面 (可多选)。
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 。
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为 和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示: 
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ;第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:______________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:_________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是____________________________________ 。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前,_______ 和_______是主要的去离子方法。
(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。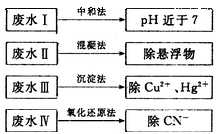
①废水I若采用CO2处理,离子方程式是_______。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为________。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++_______=CH3Hg++H+。我国规定,Hg2+的排放标准不能超过0. 05 mg/L。若某工厂排放的废水1L中含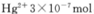 ,是否达到了排放标准_______(填“是”或“否”)。
,是否达到了排放标准_______(填“是”或“否”)。
④废水Ⅳ常用Cl2氧化CN-成CO2和N2。,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为____________
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交换的CaR2(或MgR2)型树脂置于_______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,如图是海水中利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答: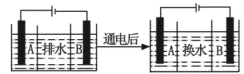
①阳离子交换膜是指____(填“A”或“B”)。②写出通电后阳极区的电极反应式____。
在宏观—微观—符号之间建立联系,是化学学科特有的思维方式。汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”便可以使汽车的尾气转换成无毒气体。下图为气体转换的微观过程,图中 表示碳原子,
表示碳原子, 表示氧原子,
表示氧原子, 表示氮原子。
表示氮原子。
请根据图示回答下列问题:
(1)A、B、C三种物质可以归为一类的依据是_________________________________________________________________
(2)将C归为化合物,将D归为单质的理由是________________________________________________________________________
(3)用化学反应方程式表示为___________________________________________。
化学变化过程中消耗的A物质和生成的C物质的质量比为________。
(4)从微观的角度去描述你获得的关于化学变化的有关信息(答出一条即可)___________________________________________________。
煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘,会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧,造成环境污染的主要原因之一是形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式____________________________。
②以下是对硝酸型酸雨的评价,其中正确的是_________________________(用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统
b.对电线、铁轨、桥梁、房屋等均会造成严重损害
c.破坏臭氧层
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥
(2)如图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式_______。
(3)脱硫以后,在废气中含量明显增加的不良气体是(写物质名称)_______,它对环境的负面影响是____________________________________________。
(4)检验脱硫后废气中是否含有SO2的简单方法是_________________________。
CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列关于CO2的说法正确的是(填序号)_________。
①减少化石燃料的使用,充分利用太阳能、风能等清洁能源可有效降低大气中CO2的含量
②植树造林,增大植被面积可以有效降低大气中CO2的含量
③二氧化硫、氮氧化物、二氧化碳、悬浮微粒的含量都是空气质量日报的内容
④空气中CO2的含量过高会导致酸雨的形成
(2)下列措施不能减少二氧化碳排放的是(填序号) _________。
①利用太阳能制氢
②关停小火电企业
③举行“地球一小时”熄灯活动
④推广使用煤液化技术
(3)下列反应不产生温室气体的是(填序号)_________。
①用纯碱制玻璃 ②用煤炭作燃料
③用铁矿石炼铁 ④用氨制碳酸铵
(4)目前,关于二氧化碳是否为大气污染物有不同的观点。认为“二氧化碳不是大气污染物”的理由是(填序号)_________。
①二氧化碳是重要的化工原料
②二氧化碳是植物光合作用的必备原料
③二氧化碳是无色、无味、无毒的气体
④除二氧化碳以外,甲烷、一氧化二氮等也是温室气体
垃圾焚烧发电产生的烟气中含烟尘、二氧化硫、氮氧化物、氯化氢等有害物质,某处理流程如下:
(1)麻石洗涤塔中设置多层格栅,上面放置大量耐酸碱塑料小球,塔内设置多层上喷下淋水嘴,“烟气”从塔底进入,目的是_____________________________________________。
(2)若NO2和NO气体以物质的量之比1∶1混合通入石灰水中,发生氧化还原反应生成一种正盐和水,请写出该反应的化学方程式:_________________________________________;
已知此正盐的水溶液呈碱性,用离子方程式表示:__________________________________。
(3)废液在沉淀池中慢慢沉降,沉淀主要含________;在回收再生池中加入NaOH固体的作用是___________________________________________。
(4)环境检测部门测量处理前后烟气中烟尘的含量见下表:
| 项 目 |
监测结果 |
国标号 |
|
| 处理前 |
处理后 |
GWKB3-2000 |
|
| 烟尘(mg·m-3) |
13 929.0 |
61.0 |
80 |
简述其获得监测结果中的数据使用的测定方法:__________________________________。
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_____________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_______________________________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是_______________,
元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
海水是宝贵的自然资源.利用海水水可以得到一系列产品.也可以进行废气处理。
(1)利用氯碱工业产品处理含SO2的烟气的流程如下: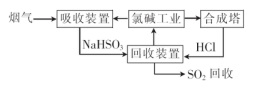
①“吸收装置”中发生反应的离子方程式是 .
②上述流程中循环利用的物质是 。
(2)利用海水脱硫可以有效地解决煤燃烧排放的SO2造成的一系列环境问题。其工艺流程如图所示:
天然海水吸收含硫的烟气后.需要用氧气进行氧化处理.其反应原理的化学方程式是 ;氧化后的海水需要加入氢氧化钠.与之混合后才能排放.该操作的主要目的是 。
(3)从海水中捉纯粗盐后的母液中含有K+、Na+、Mg2+等阳离子.对母液进行一系列的加工可制得金属镁。
①从离子反席的角度思考.在母液中加入石灰乳所起的作用是 。
②要利用MgCl2·6H2O制得尢水氯化镁.应采取的措施是 。
③电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁.下列物质中可以用作镁蒸气的冷却剂的是 (填字母)。
A.Ar B.CO2 C 空气 D.O2 E.水蒸气
试题篮
()