火电厂排放气体中含有二氧化硫、氮氧化物等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
(1)煤燃烧产生的烟气(含有氮氧化物、SO2、PM2.5等),直接排放到空气中,引发的主要环境问题有 。(填写字母编号)
| A.水体富营养化 | B.重金属污染 | C.雾霾 | D.酸雨 |
(2)将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。写出亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式:
。
(3)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:A的化学式为 ,若生成ag A,理论上可以回收SO2的质量为 g。
(4)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式 。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式_ 。
(5)工业上常用Na2CO3溶液处理煤燃烧产生的烟气,写出SO2、NO与Na2CO3溶液反应生成Na2SO4、N2的离子方程式 。
(1)图瓦卢是由多个珊瑚礁形成的岛国。由于大气中CO2含量的剧增,大量珊瑚礁(主要成分是碳酸钙)被海水侵蚀,其原因是(用化学方程式表示)___________________________________。
(2)温室效应导致海平面上升,引起温室效应的人为因素主要是_______________________。
(3)为了控制温室效应,各国科学家提出了不少方法和设想。有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底,以减小大气中CO2的浓度。为使CO2液化,可采用的措施是____________________________。
A.减压、升温 B.增压、升温 C.减压、降温 D.增压、降温
(4)科学家研究发现,用“汽水”(一种能释放CO2的弱酸性溶液)浇灌植物能促进植物的生长。原因是它能__________________________________。
①加强呼吸作用 ②加强光合作用 ③改良碱性土壤、调节pH ④加强植物蒸腾作用
A.①② B.②③ C.③④ D.②③④
(5)能快速、有效地减缓大气中CO2大量增加的生态学措施是________。
A.使用天然气等燃料
B.控制全球人口增长
C.植树造林,保护森林
D.立即减少煤和石油的燃烧
垃圾焚烧发电产生的烟气中含烟尘、二氧化硫、氮氧化物、氯化氢等有害物质,处理流程如下:
(1)麻石洗涤塔中设置多层格栅,上面放置大量耐酸碱塑料小球
,塔内设置多层上喷下淋水嘴,“烟气”从塔底进入,目的是 。
(2)若NO2和NO气体以物质的量之比1∶1混合通入石灰水中,发生氧化还原反应生成一种正盐和水,请写出反应的化学方程式 ;
已知此正盐的水溶液呈碱性,用离子方程式表示 。
(3)废液在沉淀池中慢慢沉降,沉淀主要含 ;在回收再生池中加入NaOH固体的作用是
化学与资源利用、材料研制、环境保护等密切相关。
(1)海水中蕴含的元素有80多种,它是一个巨大的宝藏。
①海水中镁的总储量约为1.8×1015 t,海水里镁的存在形式主要是 。(填“游离态”或“化合态”)
②下列物质不经过化学变化就能从海水中获得的是 。(填字母)
A.单质钠 B.单质钾 C.氯化钠
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活。
①工业上制造光导纤维的基本原料是 。
②下列物质中,不能用来制造耐火材料的是 。(填字母)
A.氧化镁 B.过氧化钠 C.三氧化二铝
(3)保持洁净安全的生存环境已成为全人类的共识。
①pH< 的雨水称为酸雨。
②下列物质中,会破坏臭氧层的是 。(填字母)
A.氮气 B.一氧化碳 C.氟氯烃
研究二氧化硫、氮氧化物、PM2.5等大气污染物的治理具有重要意义。
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样中除H+和OH﹣外其它水溶性离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3﹣ |
Cl﹣ |
| 浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH =
(2)含SO2的工业废气处理:废气的将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为 。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为 。
(3)汽车尾气中NOx和CO的生成及转化。
①已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g)
2NO(g)  H>0
H>0
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②在汽车尾气系统中安装催化转化器,使NO和CO迅速发生反应转化成对环境无污染的气体,可减少CO和NO的污染,反应的化学方程式为 。
(4)用CH4催化还原NOx可消除氮的氧化物的污染。例如:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol—1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol—1
H2O(g)= H2O(l)△H=-144kJ·mol—1
取标准状况下4.48LCH4还原NO2和NO的混合物,若氮氧化物完全被还原,且生成H2O(l),则放出的总热量Q的取值范围是 。
某化工厂甲、乙两车间排放的废水中,分别含有较多量的Na2CO3和有毒物质CuSO4,两车间排放的废气中含有较多的SO2等有害气体。环保部门建议选用生石灰、铁屑和水等廉价易得的原料,综合治理上述污染,并回收得到铜和亚硫酸钠等有用物质。写出实现上述要求的化学方程式。(可不填满)
________________________________________________________________________;
________________________________________________________________________;
________________________________________________________________________;
________________________________________________________________________。
回答下列问题:
(1)目前出现的“不粘锅”、不粘油的吸油烟机等等新型厨具,其秘密就是表面有一种叫做“特富隆”的涂层,实际上就是号称“塑料王”的聚四氟乙烯 。写出由四氟乙烯在催化剂的条件下合成聚四氟乙烯的反应方程式
。写出由四氟乙烯在催化剂的条件下合成聚四氟乙烯的反应方程式
(2)NaHCO3是制作糕点的常用疏松剂。NaHCO3受热分解反应的化学方程式是: 。
(3)“低碳生活”成为新的时尚流行全球,控制C02排放需要从人人做起,请你提出一种“低碳生活”的举措 。
现有①氟氯烃 ②二氧化碳 ③二氧化硫 ④废弃塑料制品 ⑤富含氮、磷元素的污水。请你根据已有的环保知识,选择恰当的序号填空:
(1)能形成酸雨的是 ; (2)能破坏臭氧层的是 ;
(3)使水体富营养化的是 ;(4)导致“白色污染”的是 。
中共十八大报告提出:“大力推进生态文明建设”。
(1)向燃煤中加入石灰石作脱硫剂,可大大减少SO2的排放及酸雨的发生,用这种方法最终可将煤中的硫转化为 (填化学式)。
(2)自来水厂常用漂白粉、液氯、二氧化氯、臭氧等作为消毒剂,杀灭水中的细菌。液氯注入水中后,能杀死水中细菌,写出反应的化学方程式 。
(3)对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,转化为CO2和 (填化学式)。
2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视。
(1)pH< 的雨水称为酸雨;向煤中加入适量的 ,可以大大减少燃烧产物中SO2的量。
(2)温室效应造成了地球表面温度上升。下列物质中属于温室气体的是 (填字母) 。
a.可吸入颗粒物 b.氮气 c.二氧化碳
(3)下列措施不利于改善环境质量的是 。(填字母)
a.垃圾是放错地方的资源,应分类回收利用 b.用中和法除去工业废水中的酸
c.随意的堆放生活垃圾
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
| 选项 |
污染物 |
处理措施 |
方法类别 |
| A |
废酸 |
加生石灰中和 |
物理法 |
| B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
| C |
含纯碱的废水 |
加石灰水反应 |
化学法 |
(2)下图是某市污水处理的工艺流程示意图:
① 下列物质中不可以作为混凝剂(沉降剂)使用的是 (填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝 C.碱式氯化铝 D.氯化铁
② 混凝剂除去悬浮物质的过程是 (填字母编号)。
A.只是物理过程 B. 只是化学过程 C. 是物理和化学过程
(3)在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 =" KOCN" + 2KCl + H2O 再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:口KOCN + 口KOH + 口Cl2→口CO2 + 口N2 + 口KCl + 口H2O若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为 和 。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ,
第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:__________________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:______________________________。
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是___________________________________________________。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。
研究二氧化硫、氮氧化物等大气污染物的治理具有重要意义。
(1)煤燃烧产生的烟气中含有(SO2、CO2、PM2.5等),将烟气直接排放到空气中,引发的主要环境问题有 。(填写字母编号)
| A.温室效应 | B.酸雨 | C.粉尘污染 | D.水体富营养化 |
将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为 。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为 。
(2)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下: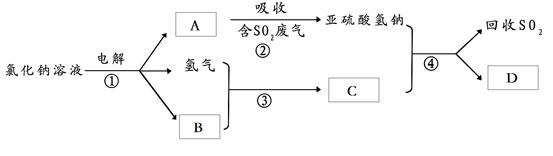 工业生产中,步骤③的反应条件为 。
工业生产中,步骤③的反应条件为 。
该工艺中物质D可以作为原料循环利用,它的化学式为 。
写出步骤②反应的离子方程式 。
(3)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式 。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式_ 。
(4)工业上常用Na2CO3溶液处理氮的氧化物。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
现用足量的Na2CO3溶液完全吸收NO和NO2的混合气体8.96L,混合气体中NO和NO2的体积比为1:3,则吸收过程中产生气体在标准状况下的体积为 。
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)下列项目:色度、浊度、pH、某些金属离子、氯离子、硫酸根离子、氮和磷的化合物、 、生化需氧量等都是评价水质需要检测的项目,其中生化需氧量主要是检测水体中 (填“哪类物质”)消耗氧气的量。
(2)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
| 选项 |
污染物 |
处理措施 |
方法类别 |
| A |
废酸 |
加生石灰中和 |
物理法 |
| B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
| C |
含纯碱的废水 |
加石灰水反应 |
化学法 |
(3)下图是某市污水处理的工艺流程示意图:
① 下列物质中不可以作为混凝剂(沉降剂)使用的是 (填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝 C.碱式氯化铝 D.氯化铁
② 混凝剂除去悬浮物质的过程是 (填字母编号)。
A.只是物理过程 B. 只是化学过程 C. 是物理和化学过程
(4)在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 =" KOCN" + 2KCl + H2O 再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:口KOCN + 口KOH + 口Cl2→ 口CO2 + 口N2 + 口KCl + 口H2O若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
2013年初,雾霾天气多次肆虐我国中东部,该地区PM2.5严重超标。研究表明,PM2.5约60%来源于某些气体污染物在空气中转变而成的二次颗粒物。这些气体污染物主要有二氧化硫、氮氧化物、氨气、挥发性有机物。因此,控制、治理PM2.5污染源成为环保的重要课题。
(1)研究表明,TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,如图所示,OH与NO2的反应为NO2+OH HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。
HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。
(2)如图所示的电解装置能吸收和转化NO2、NO和SO2。阴极排出的溶液中含S2O42-离子,能吸收NOx气体,生成的SO32-可在阴极区再生。请将S2O42-吸收NO2的离子方程式配平,并标明电子转移的方向和数目。
____S2O42-+____NO2+____OH- SO32-+____N2+____
SO32-+____N2+____

(3)已知上述电解装置阳极反应为:SO2-2e-+2H2O SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为 。
SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为 。
(4)PM2.5产生的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属等有毒物质。一般而言,粒径2.5微米至10微米的粗颗粒物主要来自扬尘等;2.5微米以下的细颗粒物(PM2.5)则主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物的排放等。请你结合信息,给出降低PM2.5排放的对策(至少两条): ______ 。
试题篮
()