在反应X+2Y====R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6 g X与Y完全反应后,生成4.4 g R,则此反应中Y和M的质量之比为
| A.16∶9 | B.23∶9 | C.32∶9 | D.46∶9 |
已知Q与R的摩尔质量之比为9:22,在反应X+2Y=2Q+R中,当1.6 g X和Y完全反应后生成4.4 g R,则参与反应的Y和生成物Q的质量之比为( )
| A.46:9 | B.32:9 | C.23:9 | D.16:9 |
现有质量分数为15%的食盐溶液20 g,质量分数为40%的食盐溶液15 g,另有足够多的食盐固体和水,要配制质量分数为20%的食盐溶液30 g。
(1)试选择多种可能的配制方法(至少四种)。
(2)若要求尽可能多地使用现有的食盐水,应如何配制?
把一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,则得反应后各物质的质量如下。下列说法中正确的是
| 物质 |
a |
b |
c |
d |
| 反应前的质量(g) |
6.4 |
3.2 |
4.0 |
2.8 |
| 反应后的质量(g) |
5.2 |
X |
7.2 |
2.8 |
A.a和c是反应物 B.d一定是催化剂
C.X=2.0g D.该反应是化合反应
一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000
mol/L的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol/L)为(提示:①H2C2O4是二元弱酸;②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O)
| A.0.008889 | B.0.0800 | C.0.1200 | D.0.2400 |
某非金属单质A和氧气发生化合反应生成B,B为气体,其体积是反应掉氧气体积的两倍(同温同压)。以下对B分子组成的推测一定正确的是
| A.有1个氧原子 | B.有2个氧原子 |
| C.有1个A原子 | D.有2个A原子 |
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O32—+O2+aOH-=Y+S4O62—+2H2O,下列说法中,不正确的是( )
| A.a=4 |
| B.Y的化学式为Fe2O3 |
| C.S2O32—是还原剂 |
| D.每有1 mol O2参加反应,转移电子的总物质的量为4 mol |
已知35%NaOH溶液的密度为1.38g·cm-3,5%NaOH溶液的密度为1.05g·cm-3,若将上述两种溶液等体积混合,所得NaOH溶液的质量分数是
| A.大于20% | B.等于20% | C.小于20% | D.无法确定 |
在标准状况下,一个装满氧气的容器质量为74g,若装满氮气时质量是66g,此容器的体积是( )
| A.4.48L | B.11.2L | C.22.4L | D.44.8L |
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用下图装置加热硫酸铜粉末直至完全分解。硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如下表所示。
| 装置 |
A(试管+粉末) |
B |
C |
| 反应前 |
42.0g |
75.0g |
140.0g |
| 反应后 |
37.0g |
79.5g |
140.0g |

请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是
A.3CuSO4  3CuO + SO3↑ + 2SO2↑ + O2↑
3CuO + SO3↑ + 2SO2↑ + O2↑
B.4CuSO4  4CuO + 2SO3↑ + 2SO2↑ + O2↑
4CuO + 2SO3↑ + 2SO2↑ + O2↑
C.5CuSO4  5CuO + SO3↑ + 4SO2↑ + 2O2 ↑
5CuO + SO3↑ + 4SO2↑ + 2O2 ↑
D.6CuSO4  6CuO + 4SO3↑ + 2SO2↑ + O2↑
6CuO + 4SO3↑ + 2SO2↑ + O2↑
若两物质恰好完全反应,下列各项中反应前后保持不变的是
①电子总数 ②原子总数 ③分子总数 ④物质的总能量 ⑤物质的总质量
| A.①②⑤ | B.①③⑤ | C.②③④ | D.②④⑤ |
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为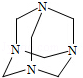
| A.1:1 | B.2:3 | C.3:2 | D.2:1 |
将20gM物质、5gN物质、9gP物质混合加热发生化学变化,经充分反应后的混合物中含有5gM物质、20gP物质还含有一种新物质Q,若M、N、P、Q的相对分子质量分别为30、20、44、18,它们之间发生反应的化学方程式是( )
| A.M+N=P+Q | B.M+2N=2P+Q |
| C.2M+N=2P+Q | D.2M+N=P+2Q |
试题篮
()