(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为
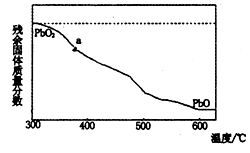
已知PbO2与硝酸不反应且氧化性强于硝酸,而PbO是碱性氧化物,能和酸反应,写出上述分解产物与硝酸反应的化学方程式
(2)①另一实验小组也取一定量的PbO2加热得到了一些固体,为探究该固体的组成,取一定质量该固体加入到30 mLCH3COOH一CH3COONa溶液中,再加入足量KI固体,摇荡锥瓶使固体中的PbO2与KI全部反应而溶解,得到棕色溶液。写出PbO2参与该反应的化学方程式 ,用淀粉指示剂,0.2 mol/L的Na2S2O3标准溶液滴定至溶液蓝色刚消失为止,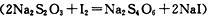 ,Na2S2O3标准溶液的消耗量为20 mL。
,Na2S2O3标准溶液的消耗量为20 mL。
②固体加入到醋酸而非盐酸中是因为会产生有毒气体,写出反应的化学方程式
用CH3COOH一CH3COONa的混合液而不用CH3COOH可以控制pH不至于过低,否则会产生浑浊和气体,请写出该反应的化学方程式
③取相同质量的上述固体与硝酸混合,过滤出的滤液加入足量的铬酸钾溶液得到铬酸铅(PbCrO2相对分子质量323)沉淀,然后 ,得固体质量为0.969g,依据上述数据,该固体的分子式 。
(1)相同质量的CO 和CO2所含分子的数目之比为 ,原子的物质的量之比为 ,在同温同压下气体的体积之比是 。
(2)100mL Al2(SO4)3溶液中c(SO42-)=0.9mol/L,则c(Al3+)= mol/L,n[Al2(SO4)3]= mol。
(3)已知8g A能与32g B恰好完全反应,生成22gC和一定量D,现将16g A与足量B的混合物充分反应后,生成2mol D和一定量的C,则D的摩尔质量为 。
(4)若1g N2中含有x个原子,则阿伏加德罗常数NA= 。(用所给数字及符号填空)
(5)将钠和铝的混合物0.2mol溶于足量的盐酸中,产生3136mL(标准状况)氢气,则钠和铝的物质的量之比为 。
学习化学要准确掌握化学基本概念和研究方法。按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:
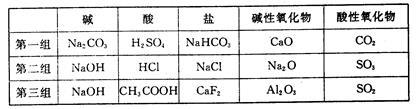
找出上述三组分类中的错误,错误物质的化学式为 。
(2)下列2个反应,按要求填写相关量。
①2Na2O2+ 2H2O=4NaOH+O2反应中,每消耗lmol Na2O2生成 g O2;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是 (填代号)
A.NaOH B.AgNO3 C.HCl D.Na2SO4
(3)配平下面化学方程式,回答下列问题:
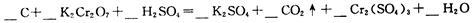
①H2SO4在上述反应中表现出来的性质是(填选项编号) .
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_____L。
(4)在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,按要求回答下列问题:
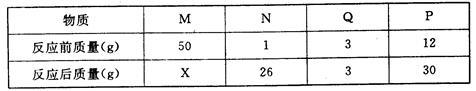
该变化的基本反应类型是 反应,Q物质的作用为 。
根据下图中A、B两种固体物质的溶解度曲线,回答下列问题:
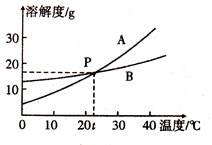
(1)10oC时,将10gB溶于100g水中,形成溶液的质量是 ,将它变成饱和溶液可采用的一种方法是 。
(2)P点的含义是 。在30oC时,A、B两物质饱和溶液的溶质质量分数的大小关系为A B(填“>”“<”或“=”)。当A中含有少量B 时,提纯A所采用的方法为 。
结构决定物质的性质、变化,请结合下图回答问题。
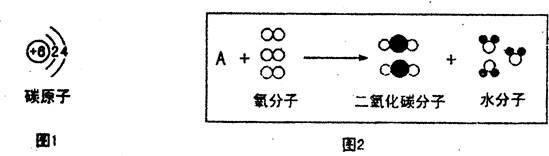
(1)由图1可知,在常温下,碳的化学性质不活泼的微观原因是 ;
(2)图2中A的化学式可能是 ,写出与图2反应微观本质不同的一个化学方程式 。
如下左图是甲、乙两种物质的溶解度曲线,右图所示两个烧杯中各盛有20℃时两种物质的饱和溶液。请你通过分析,回答下列问题:
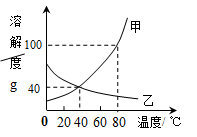
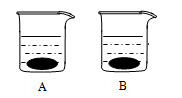
(1)下列方法中能使甲物质的溶解度增大的是
| A.溶解时搅拌 | B.升高温度 | C.降低温度 | D.增加水的质量 |
(2)在80℃时,将55克甲物质放到50克水中,形成溶液的质量是 克。
(3)不改变溶质质量分数使接近饱和的乙的不饱和溶液变为饱和溶液的方法是 。
(4)当温度由20℃升高到60℃时(不考虑水分蒸发),B烧杯中固体质量增多,则B烧杯溶液中的溶质是 (填“甲”或“乙”)。
(5)将80℃的甲、乙饱和溶液降温到40℃,得到的溶液中溶质的质量分数大小关系是甲 乙(填“>”、“=”或“<”)。
(6)甲中含有少量乙时,提纯甲的方法是 。
气体化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10mLA气体能分解生成15mLO2和10mLF2(同温同压下),则A的化学式是 ,推断的依据是 和 。
在实验室配制溶液时,常涉及以下过程:①称量、量取;②过滤;③蒸发结晶、干燥;④计算;⑤溶解.
请按要求回答下列问题:
(1)甲同学用氯化钠和蒸馏水配制50 g 5%的氯化钠溶液.正确的操作顺序是:___________________.(用以上序号填空)现实验室中有10mL,50mL,100mL等不同规格的量筒,配制 上述溶液时最好选用_______mL的量筒.
(2)乙同学用10g含杂质10%的食盐(杂质不溶于水)和蒸馏水配制50g,5%的氯化钠溶液.正确的操作顺序是:____________________________.(用以上序号填空)
t1℃时硝酸钠的饱和溶液的质量分数为20%,已知t 2 ℃硝酸钠的溶解度为t 1 ℃时的溶解度的三倍,则t 2 ℃时硝酸钠饱和溶液的质量分数为______________.
将50 g 25%的氯化钾溶液与40 g 5%的氯化钾溶液混合所得溶液的质量分数为______________;若用20%和10%的氯化钾溶液配制200g12%的氯化钾溶液,需20%的氯化钾溶液__________g,10%的氯化钾溶液______________g.
用锌片与稀硫酸反应,实验结果记录如表
| 次数 |
加入Zn质量/g |
加入稀硫酸质量/g |
生成ZnSO 4 质量/g |
| 1 |
2 |
60 |
5 |
| 2 |
4 |
60 |
|
| 3 |
6 |
60 |
15 |
| 4 |
8 |
60 |
17 |
| 5 |
10 |
60 |
|
| 6 |
12 |
60 |
17 |
(1)第2、5两次产生ZnSO4 的质量依次是______________g.
(2)在图中画出ZnSO4 与Zn的质量函数关系的曲线. 
(3)(10+m)g锌与60g稀硫酸充分反应后,剩余固体的质量为______________g.
(4)稀硫酸的溶质质量分数是______________.
实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①量取25.00 mL甲溶液,向其中缓慢滴入乙溶液15.00 mL,共收集到224 mL(标准状况)气体。
②量取15.00 mL乙溶液,向其中缓慢滴入甲溶液25.00 mL,共收集到112 mL(标准状况)气体。
(1)判断:甲是________溶液,乙是_________溶液。
(2)实验②中所发生反应的离子方程式为_____________________________。
(3)甲溶液的物质的量浓度为,乙溶液的物质的量浓度为___________________。
(4)将n mL甲溶液与等体积乙溶液按上述两种实验方式进行反应,所产生的气体的体积为V mL(标准状况),则V的取值范围是____________________________________。
将CO2通入NaOH溶液中,所得产物随通入的CO2的物质的量的不同而不同。完成下列填空。
(1)250 mL 1 mol/L的NaOH溶液,最多可吸收CO2 L(标准状况下)。
(2)向250 mL 2 mol/L的NaOH溶液中通入一定量CO2,溶液增重4.4 g,将所得溶液蒸干,计算所得固体中各成分的物质的量。
向未知浓度、体积为V L的 NaOH溶液中缓缓通入一定体积(标准状况下)的CO2,充分反应后,在减压低温的条件下蒸发溶液,得到白色固体。
(3)若反应中CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成m1 g 白色沉淀。
①根据以上数据,用代数式表示CO2的体积V(CO2)= 。
②根据以上数据,推理计算出NaOH溶液的浓度范围。
(4)写出确定NaOH浓度的实验步骤,并用代数式表示NaOH溶液的浓度。(设计实验方案时,只能用题中提供的CO2和NaOH溶液,不得使用其它化学试剂。)
实验步骤: 。c(NaOH)= 。
钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。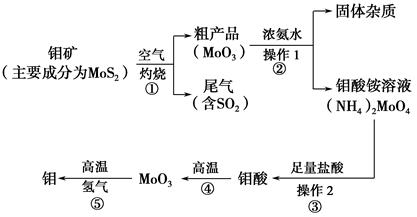
(1)写出反应①的化学方程式: 。
(2)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂 。
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有 。
(4)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为 。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
试题篮
()