下列事实不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+H2O HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅。 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅。 |
B.对CO(g)+NO2(g) CO2(g)+NO(g),平衡体系增大压强可使颜色变深。 CO2(g)+NO(g),平衡体系增大压强可使颜色变深。 |
| C.升高温度能够促进水的电离。 |
| D.工业上合成NH3的反应,为提高NH3的产率,理论上应采取相对较低温度的措施。 |
一定温度下的反应A(g)+3B(g) 2C(g),下列叙述不能表明它达到化学平衡的是
2C(g),下列叙述不能表明它达到化学平衡的是
A.A、B、C的浓度不再变化
B.混合气体的总物质的量不再变化
C.单位时间内生成a mol A,同时生成3amol B
D.C的生成速率与C的分解速率相等
下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是:
A.2NO2 N2O4(正反应为放热反应) N2O4(正反应为放热反应) |
B.C(固)+CO2 2CO (正反应为吸热反应) 2CO (正反应为吸热反应) |
C.N2+3H2 2NH3(正反应为放热反应) 2NH3(正反应为放热反应) |
D.H2S H2+S(固)(正反应为吸热反应) H2+S(固)(正反应为吸热反应) |
一定条件下反应2AB(g)  A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成n molA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
I.现有下列物质:
1、CI2 2、Na2O2 3、NaOH 4、HCl 5、H2O2 6、MgF2 7、Mg3N2
(1)只有离子键构成的物质是 (2)只有极性键构成的物质是
(3)只有非极性键构成的物质 (4)有极性键和非极性键构成的物质是
(5)有离子键和极性键构成的物质是(6)有离子键和非极性键构成的物质是
(7)属于离子化合物的是 (8)属于共价化合物的是
II.能够说明可逆反应2NO2 N2O4达到平衡状态的标志是_____________
N2O4达到平衡状态的标志是_____________
①单位时间消耗2mol NO2的同时,生成1 mol N2O4 ②恒温恒压下,混合气体的密度不变 ③NO2和N2O4的浓度之比为2∶1 ④混合气体的颜色不变 ⑤单位时间消耗4mol NO2的同时,消耗2mol N2O4
合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的N2(g)+3H2(g) 2NH3(g),在673K 30MPa下,n(NH3)和n(H2)随时间变化的关系如上图所示。下列叙述正确的是
2NH3(g),在673K 30MPa下,n(NH3)和n(H2)随时间变化的关系如上图所示。下列叙述正确的是
| A.a点的正反应速率比b点的小 |
| B.d点和e点n(N2)不相等 |
| C. c点反应达平衡 |
| D. d点的正反应速率与e点正反应速率相等 |
(1)在2L的密闭容器中,加入2molSO2、1.2molO2,充分反应后,容器内压强为反应前的3/4,则SO2、O2 的转化率分别为多少?
(2)将11. 2L标准状况下的甲烷和乙烯的混合气体通入足量的溴的四氯化碳溶液中充分反应,溴的四氯化碳溶液增加了5.6g,求原混合气体中甲烷与乙烯的质量之比。
一定条件下,可逆反应X(g)+3Y(g)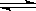 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol· L-1、0.3mol· L-1、0.08mol· L-1,则下列判断不正确的是 ( )
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol· L-1、0.3mol· L-1、0.08mol· L-1,则下列判断不正确的是 ( )
| A.c1:c2的值不能确定 | B.平衡时,Y和Z的生成速率之比为3:2 |
| C.0.28mol·L-1<c1+c2+c3< 0.56mol·L-1 | D.c1的取值范围为0<c1<0.14 mol·L-1 |
某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2 SO2+ O2 2 SO3反应。5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%。求
2 SO3反应。5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%。求
⑴以SO3的浓度变化表示该反应的化学反应速率;
⑵该反应中SO2的平衡转化率。
下图表示反应X(g)  4Y(g) +Z(g);在某温度时X的浓度随时间变化的曲线。下列有关该反应的描述正确的是( )
4Y(g) +Z(g);在某温度时X的浓度随时间变化的曲线。下列有关该反应的描述正确的是( )
| A.第6min后,反应就停止了 |
| B.X的平衡转化率为85% |
| C.反应只进行了6min |
| D.在1min内X的平均反应速率为0.7 mol·L-1·min-1 |
T ℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.保持其他条件不变,升高温度,平衡逆向移动 |
| C.反应进行的前3min内,用X表示的反应速率 v(X)=0.1mol·L-1·min-1 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生如下反应:A(g) + 3B(g)  2C(g)
2C(g)
(1)向M、N中,各通入1mol A和3mol B。初始M、N容积相同,并保持温度不变。则到达平衡时A的转化率α(A)M α(A)N A的体积分数x(A)M x(A)N
(2))向M、N中,各通入x molA和y molB,初始M、N容积相同,并保持温度不变。若要平衡时保持A气体在M、N两容器中的体积分数相等,则起始通入容器中的A的物质的量xmol与B的物质的量ymol之间必须满足的关系式为
(3)若在某件下,反应A(g) + 3B(g)  2C(g)在容器N中达到平衡,测得容器中含有A 1.0mol,B 0.4mol,C 0.4mol,此时容积为2.0L。则此条件下的平衡常数为 ;保持温度和压强不变,向此容器内通入0.36mol A,平衡将 (填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由
2C(g)在容器N中达到平衡,测得容器中含有A 1.0mol,B 0.4mol,C 0.4mol,此时容积为2.0L。则此条件下的平衡常数为 ;保持温度和压强不变,向此容器内通入0.36mol A,平衡将 (填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由
。
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法错误的是
A.反应CO(g)+H2O(g) CO2(g)+H2(g)的△H>0 CO2(g)+H2(g)的△H>0 |
| B.在T2时,若反应进行到状态D,则一定有v正<v逆 |
| C.平衡状态A与C相比,平衡状态A的c(CO)小 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:2H1(g) I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
| A.保持容器体积不变,升高温度,混合气体的颜色逐渐变浅 |
| B.保持容器体积与温度不变,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大 |
| C.保持温度不变,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=25mol/L |
| D.保持容器压强和温度不变,再通入2molHI气体,到达平衡状态后,测得HI的转化率为60% |
将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g) 2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
| |
改变条件 |
新平衡与原平衡比较 |
| A |
升高温度 |
X的转化率变小 |
| B |
增大压强 |
X的浓度变小 |
| C |
充入一定量Y |
Y的转化率增大 |
| D |
使用适当催化剂 |
X的体积分数变小 |
试题篮
()