对于可逆反应 达到平衡时,下列说法中正确的是( )
达到平衡时,下列说法中正确的是( )
| A.M、N、Q三种物质的浓度一定相等 | B.M、N全部变成了Q |
| C.反应混合物各组分的浓度不再变化 | D.压强不再变化 |
向容积为2L的密闭容器中充入2molX气体和lmo1Y气体,在一定条件下发生如下反应: 2X(g)+Y(g)
2X(g)+Y(g) 3R(g),该反应经2s后达到平衡,测得R气体的浓度为0.6mol/L。下列说法中错误的是( )
3R(g),该反应经2s后达到平衡,测得R气体的浓度为0.6mol/L。下列说法中错误的是( )
| A.用物质X表示该反应在2s内的平均反应速率为0.2 mol/(L·s) |
| B.其他条件不变,向容器中再加入l mol R气体,达到新的平衡后,R的体积分数不变 |
C.其他条件不变,加压缩小容器体积时平衡不移动,气体密度和平均相对分子质量均增大 |
D.平衡时物质X与Y的转化率相等 |
某温度下,在2L容器中3种物质间进行反应, X、Y、Z的物质的量随时间的变化曲线如图。反应在t1min时到达平衡,依图所示:
⑴①该反应的化学方程式是_____________________。
②在t1min时,该反应达到了__________状态,下列可作
为判断反应已达到该状态的是________ __(填序号)。
| A.X、Y、Z的反应速率相等 | B.X、Y的物质的量浓度不再改变 |
| C.生成3molY的同时生成1molZ | D.生成1molZ的同时生成2molX |
⑵①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则由H2、N2合成NH3反应的热化学反应方程式为:
___________ ___。
②甲、乙两位同学讨论放热反应和吸热反应:甲说加热后才能发生的化学反应是吸热反应;乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们说法正确的是_ ____同学。
在一定温度下的恒容密闭容器中,当下列物理量不再发生变化时,表明可逆反应A(g)+2B(g)  C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
①混合气体的压强 ②混合气体的体积
③B的物质的量浓度 ④气体的总质量
| A.②③ | B.①③ | C.③④ | D.①④ |
哈伯因发明氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生。下列有关说法正确的是
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,正反应和逆反应的速率都为零 |
| D.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
500℃、20Mpa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是
| A.反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L·min) |
| B.从曲线变化可以看出,反应进行到10min至20min钟时可能是使用了催化剂 |
| C.从曲线变化可以看出,反应进行至25min钟时,分离出0.2mol的氨气 |
| D.在25min钟时平衡正向移动但达到新平衡后 NH3的体积分数比原平衡小 |
如图,容器A左侧是可平行移动的活塞。向A中充入1molX的1molY,向B中充入2molX和2molY,起始时A、B的体积都等于a L。在相同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中各自反应:X (g)+ Y(g)  Z(g)+2W(g)。达平衡时,A的体积为1.2 a L 。下列说法正确的是
Z(g)+2W(g)。达平衡时,A的体积为1.2 a L 。下列说法正确的是
A.反应速率:v(B) >v(A)
>v(A)
B.A容器中X的转化率为 20%
C.平衡时的压强:PB=2PA
D.若打开K,则达到新的化学平衡时,A的体积为2.6a L
某条件下在密闭容器中发生反应X2 + 3Y2 2Z2,下图是反应过程中,反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2Z2,下图是反应过程中,反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
| A.0~t1时,X2、Y2、Z2的物质的量浓度由于反应进行而减小 |
| B.t2~t3时,反应体系中Y2的浓度没有变化 |
| C.到t3以后,反应已达限度,不管如何改变条件,反应不再进行 |
| D.从关系曲线可知,反应开始时体系中只有X2和Y2 |
可逆反应H2(g)+ I2(g) 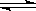 2HI(g)达到平衡时的标志是( )
2HI(g)达到平衡时的标志是( )
| A.H2、I2、HI的浓度相等 | |
| B.1个I—I键断裂的同时,有2个H—I键断裂 | |
| C.混合气体的质量不再改变 | D.混合气体密度恒定不变 |
可逆反应在一定条件下达到反应限度(化学平衡状态)的标志是
| A.反应停止了 | B.正反应速率与逆反应速率均为零 |
| C.反应物和生成物浓度相等 | D.正反应速率与逆反应速率相等 |
在100℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,发生反应:
2NO2 N2O4。每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
N2O4。每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间/s |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
(1)在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为__________
mol/(L·s)。
(2)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是_________mol/L。假设在80s时达到平衡,请在如图中画出该条
件下N2O4和NO2的浓度随时间变化的曲线。
(3)上述(2)达到平衡后四氧化二氮的转化率为_________,混合气体的平均摩尔质量
为___________。
(4)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡将 (填“向左移动”、“向右移动”或“不移动”)。
粗镍经过下列过程可以转化为纯度99.9%的高纯镍,发生的反应是
下列说法正确的是
| A.50~80℃时,适当增大压强,有利于Ni(CO)4的生成 |
| B.180~200℃时,气态的Ni(CO)4 会分解出纯Ni |
| C.提纯过程中,CO(g)的量不断减少 |
| D.温度越高,Ni(CO)4 (g)的转化率越低 |
吸热反应N2(g)+O2 (g)  2NO(g),在2000℃时,K=6.2×10-4.2000℃时,在10L密闭容器内放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2,通过计算回答:(1)此反应的初始状态是否为化学平衡状态?
2NO(g),在2000℃时,K=6.2×10-4.2000℃时,在10L密闭容器内放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2,通过计算回答:(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行?
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s) bZ(g);△H<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。下列说法正确的是( )
bZ(g);△H<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。下列说法正确的是( )
A.用Y表示0~10min内该反应的平均速率为0.05mol/(L·min)
B.根据上图可求得方程式中a:b=2:1 0~10min容器内气体的压强逐渐增大
0~10min容器内气体的压强逐渐增大
D.第13min时曲线变化的原因可能是增加了Z的量
可逆反应2NO2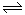 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是①混合物各物质的量的浓度相等 ②单位时间内生成n mol O2的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是①混合物各物质的量的浓度相等 ②单位时间内生成n mol O2的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
| A.①④ | B.②④ | C.①③④ | D.①②③④⑤ |
试题篮
()