已知:C(s)+CO2(g) 2CO(g);△H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是 ( )
2CO(g);△H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是 ( )
| A.升高温度和减小压强 | B.降低温度和减小压强 |
| C.降低温度和增大压强 | D.升高温度和增大压强 |
25 ℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液,下列判断不正确的是
| A.均存在电离平衡和水解平衡 |
| B.存在的粒子种类相同 |
| C.c(OH―)前者大于后者 |
| D.分别加入NaOH固体,恢复到原温度,c(CO)均增大 |
t ℃将3molA和2molB气体通入固定体积为2L的密闭容器中,发生如下反应:
3A(g)+ B(g) XC(g),2min时反应达平衡。(温度不变)剩余1.8molB,
XC(g),2min时反应达平衡。(温度不变)剩余1.8molB,
并测得C的物质的量为0.8mol,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 ,X= 。
(2)比较达到平衡时,A.B两反应物的转化率:α(A) α(B)(填> = 或 < )
(3)若继续向原平衡混合物的容器中通入少量氩气(氩气和A.B.C均不反应)后,则平衡
(填“向左移动” “ 向右移动” “不移动”)
(4)在t ℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入 mol(填A或B物质并用含a的式子表示量的多少)
工业制硫酸中,存在可逆反应2SO2(g)+ O2(g) 2SO3(g),在已达到平衡后的反应容器中充入少量18O2,一段时间后18O存在于:
2SO3(g),在已达到平衡后的反应容器中充入少量18O2,一段时间后18O存在于:
| A.O2 | B.O2和SO2 | C.O2和SO3 | D.SO2、O2和SO3 |
某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别为:c(X2)=0.4 mol·L-1,c(Y2)=0.8 mol·L-1,c(Z)=0.4 mol·L-1,则该反应的反应式可表示为:
A.X2+2Y2  2XY2 2XY2 |
B.2X2+Y2 X2Y X2Y |
C.3X2+Y2 2X3Y 2X3Y |
D.X2+3Y2 2XY3 2XY3 |
反应:A(g)+B(g) C(g),A的含量和温度的关系如图所示,下列结论正确的是:
C(g),A的含量和温度的关系如图所示,下列结论正确的是:
| A.T1>T2, 正反应吸热 | B.T1<T2, 正反应吸热 |
| C.T1>T2, 正反应放热 | D.T1<T2, 正反应放热 |
在某温度下,将H2(g)和I2(g)各0.1mol的气体混合物充入10L的密闭容器中,充分反应,达到平衡时,测得c(H2)=0.0080mol/L,
求:
(1)求该反应的平衡常数。
(2)在上述温度下,该容器中若充入的H2(g)和I2(g)各0.2mol,求达到化学平衡时HI(g)的平衡浓度。
牙齿表面覆盖的牙釉质是人体中最坚硬的部分,起着保护牙齿的作用,其主要成分为羟基磷酸钙[Ca5(PO4)3OH]。在牙齿表面存在着如下平衡:
Ca5(PO4)3OH(s)  5Ca2+(aq)+3PO43-(aq)+OH- (aq) Ksp = 6.8×10-37 mol9·L-9
5Ca2+(aq)+3PO43-(aq)+OH- (aq) Ksp = 6.8×10-37 mol9·L-9
下列说法错误的是
| A.残留在牙齿上的糖发酵会产生H+,经常吃糖易造成龋齿 |
| B.由上述平衡可知,小孩长牙时要少吃糖多补钙 |
| C.若减小OH-的浓度,上述平衡将向右移动,Ksp的值相应增大 |
| D.使用含氟牙膏能防止龋齿,是因为Ca5(PO4)3OH(s)转化为更难溶的Ca5(PO4)3F(s) |
[ Ca5(PO4)3F(s)的Ksp = 2.8×10-61 mol9·L-9]
某化学科研小组研究在其他条件不变时,改变其一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):
根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:△H>0, |
B.反应Ⅱ:△H>0, |
| C.反应Ⅲ:△H>0 | D.反应Ⅳ:△H<0, |
Ⅰ.在一定条件下,xA+yB zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向 方向移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为 。
Ⅱ.已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。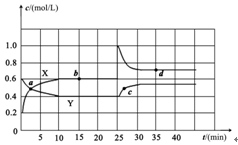
(1)图中共有两条曲线X和Y,其中曲线 表示NO2浓度随时间的变化;
a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
下列不能说明该反应已达到平衡状态的是 。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均分子量不随时间变化而改变
(2)前10min内用NO2表示的化学反应速率v(NO2)= 。
(3)反应25min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是 (用文字表达);
(4)若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是 。
A.加入催化剂 B.缩小容器体积 C.升高温度 D.加入一定量的N2O4
在容积相等的两个密闭容器A和B中,保持温度为423K,同时向A、B中分别加入a mol和b mol HI(a > b),发生反应2HI(g)  H2(g)+I2(g)达到平衡后,下列说法中,正确的是:
H2(g)+I2(g)达到平衡后,下列说法中,正确的是:
A.从开始反应到达平衡,所需时间tA>tB
B.平衡时,I2蒸气在混合气体中的体积分数φA>φB
C.平衡时,I2蒸气的物质的量浓度[I2]A=[I2]B
D.HI的平衡转化率,αA=αB
已知合成氨的反应为:N2(g)+3H2(g) 2NH3(g);△H=-QkJ·mo(Q>0)。
2NH3(g);△H=-QkJ·mo(Q>0)。
在同温同压下向密闭容器甲中通入lmolN2和3molH2,达平衡时,放出的热量为QlkJ;
向另一容积相同的密闭容器乙中通入0.5molN2和1.5 molH2,反应达平衡时,放出的热量为Q2kJ。则下列关系式正确的是
| A.2Q2<Ql<Q | B.2Q2=Q1<Q | C.2Q2=Q1=Q | D.Ql<Q2<Q |
高炉炼铁中发生的基本反应之一如下:
FeO(s)+ CO (g)  Fe(s)+ CO2(g) △H>0
Fe(s)+ CO2(g) △H>0
(1)此反应的平衡常数表达式为:K=
(2)温度升高,达到新的平衡后,高炉内CO2与CO的体积比 (填“增大”、 “减小”或“不变”)。
(3)已知1100℃时,K= 0.263。某时刻测得高炉中c(CO2)=" 0.025" mol·L-1,c(CO)=" 0.1" mol·L-1,在这种情况下,该反应 (填“是”或“不是”)处于化学平衡状态。
如果“不是”,此时化学反应向 方向进行(填“正反应”或“逆反应”)。如果“是”,此空不填
在密闭容器中,反应X2(g) + Y2(g) 2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
A图I是加入适当催化剂的变化情况
B图II是扩大容器体积的变化情况
C 图III是增大压强的变化情况
D图III是升高温度的变化情况
高炉炼铁中发生的基本反应如下:FeO(s)+CO(g)s Fe(s)+CO2(g) △H>0。
Fe(s)+CO2(g) △H>0。
(1)下列可以作为判断该反应已经达到化学平衡状态依据的是 。
a.高炉内压强不变
b.CO2的生成速率和CO的生成速率相等
c.混合气体中CO2的浓度不变
d.c(CO2)=c(CO)
(2)此反应的平衡常数表达式为K= 。
(3)温度升高平衡常数K值 (填“增大”“减小”、或“不变”)。
(4)已知1100℃时,K=0.263,此时测得高炉中c(CO2)="0.025mol/L" ·c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态 (填“是”或“否”),此时化学反应速率是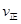
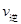 (填“<”、“>”或“=”),其原因是 。
(填“<”、“>”或“=”),其原因是 。
试题篮
()